Epivir 150mg Lamivudine Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Epivir, og hvordan bruges det?
Epivir 150mg er en receptpligtig medicin, der bruges til at behandle symptomerne på HIV-infektion og kronisk hepatitis B. Epivir 150mg kan bruges alene eller sammen med anden medicin.
Epivir tilhører en klasse af lægemidler kaldet hepatitis B/hepatitis C-midler; HIV, NRTI'er.
Det vides ikke, om Epivir er sikkert og effektivt til børn under 3 måneder.
Hvad er de mulige bivirkninger af Epivir 150mg?
Epivir kan forårsage alvorlige bivirkninger, herunder:
- nældefeber,
- åndedrætsbesvær,
- hævelse af dit ansigt, læber, tunge eller hals,
- usædvanlige muskelsmerter,
- mavesmerter,
- opkastning,
- uregelmæssig puls,
- svimmelhed,
- føler sig kold,
- svaghed,
- træthed,
- stærke smerter i din øvre mave breder sig til ryggen,
- kvalme,
- hurtig puls,
- hævelse omkring din midsektion,
- højresidet øvre mavesmerter,
- mistet appetiten,
- mørk urin,
- lerfarvede afføring,
- gulfarvning af huden eller øjnene (gulsot),
- feber,
- nattesved,
- hævede kirtler,
- forkølelsessår,
- hoste,
- hvæsen,
- diarré,
- vægttab,
- problemer med at tale eller synke,
- problemer med balance eller øjenbevægelser,
- stikkende følelse,
- hævelse i din nakke eller hals (forstørret skjoldbruskkirtel),
- menstruationsændringer, og
- impotens
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Epivir omfatter:
- kvalme,
- diarré,
- hovedpine,
- feber,
- træthed,
- generel dårlig følelse,
- øresmerter eller fuld følelse,
- problemer med at høre,
- dræning fra øret,
- kræsenhed hos et barn,
- tilstoppet næse,
- nyser,
- ondt i halsen, og
- hoste
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Epivir. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FORÆRRINGER AF HEPATITIS B og FORSKELLIGE FORMULERINGER AF EPIVIR.
Eksacerbationer af hepatitis B
Alvorlige akutte eksacerbationer af hepatitis B er blevet rapporteret hos patienter, der er co-inficeret med hepatitis B-virus (HBV) og humant immundefektvirus (HIV-1) og har seponeret EPIVIR. Leverfunktionen bør overvåges nøje med både klinisk og laboratorieopfølgning i mindst flere måneder hos patienter, der seponerer EPIVIR og samtidig er inficeret med HIV-1 og HBV. Hvis det er relevant, kan påbegyndelse af anti-hepatitis B-behandling være berettiget [se ADVARSLER OG FORHOLDSREGLER].
Vigtige forskelle mellem Lamivudin-holdige produkter
EPIVIR 150 mg tabletter og oral opløsning (bruges til behandling af HIV-1-infektion) indeholder en højere dosis af det aktive stof (lamivudin) end EPIVIR-HBV-tabletter og oral opløsning (bruges til behandling af kronisk HBV-infektion). Patienter med HIV-1-infektion bør kun modtage doseringsformer, der er passende til behandling af HIV-1 [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
EPIVIR (også kendt som 3TC) er et varemærke for lamivudin, en syntetisk nukleosidanalog med aktivitet mod HIV-1 og HBV. Det kemiske navn på lamivudin er (2R,cis)-4-amino-1(2-hydroxymethyl-1,3-oxathiolan-5-yl)-(1H)-pyrimidin-2-on. Lamivudin er (-)enantiomeren af en dideoxyanalog af cytidin. Lamivudin er også blevet omtalt som (-)2',3'-dideoxy, 3'thiacytidin. Den har en molekylformel på C8H11N3O3S og en molekylvægt på 229,3 g pr. mol. Den har følgende strukturformel:
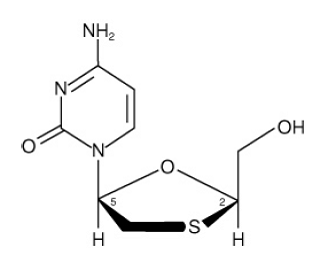
Lamivudin er et hvidt til råhvidt krystallinsk fast stof med en opløselighed på ca. 70 mg pr. ml i vand ved 20°C.
EPIVIR 150 mg tabletter er til oral administration. Hver 150 mg filmovertrukket tablet med delekærv indeholder 150 mg lamivudin og de inaktive ingredienser hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, natriumstivelsesglykolat og titaniumdioxid.
Hver 300 mg filmovertrukket tablet indeholder 300 mg lamivudin og de inaktive ingredienser sort jernoxid, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, natriumstivelsesglycolat og titaniumdioxid.
EPIVIR oral opløsning er til oral administration. En milliliter (1 ml) EPIVIR oral opløsning indeholder 10 mg lamivudin (10 mg pr. ml) i en vandig opløsning og de inaktive ingredienser kunstige jordbær- og bananaromaer, citronsyre (vandfri), methylparaben, propylenglycol, propylparaben, natriumcitrat (dihydrat) og saccharose (200 mg).
INDIKATIONER
EPIVIR 150mg er en nukleosidanalog indiceret i kombination med andre antiretrovirale midler til behandling af human immundefektvirus type 1 (HIV-1) infektion.
Brugsbegrænsninger
- Doseringen af dette produkt er til HIV-1 og ikke til HBV.
DOSERING OG ADMINISTRATION
Anbefalet dosering til voksne patienter
Den anbefalede dosis af EPIVIR 150 mg til HIV-1-inficerede voksne er 300 mg dagligt, indgivet som enten 150 mg oralt to gange dagligt eller 300 mg oralt én gang dagligt med eller uden mad. Hvis lamivudin administreres til en patient, der er inficeret med HIV-1 og HBV, bør den dosis, der er indiceret til HIV-1-behandling, anvendes som en del af et passende kombinationsregime [se ADVARSLER OG FORHOLDSREGLER ].
Anbefalet dosering til pædiatriske patienter
EPIVIR 150 mg tablet med delekærv er den foretrukne formulering til HIV-1-inficerede pædiatriske patienter, som vejer mindst 14 kg, og for hvem en fast dosisform er passende. Før ordinering af EPIVIR-tabletter med delekærv, bør pædiatriske patienter vurderes for evnen til at sluge tabletter. Til patienter, der ikke er i stand til sikkert og pålideligt at sluge EPIVIR 150 mg tabletter, kan formuleringen oral opløsning ordineres [se ADVARSLER OG FORHOLDSREGLER ]. Den anbefalede orale dosis af EPIVIR 150 mg tabletter til HIV-1-inficerede pædiatriske patienter er vist i tabel 1.
Oral løsning
Den anbefalede dosis af EPIVIR 150 mg oral opløsning til HIV-1-inficerede pædiatriske patienter i alderen 3 måneder og ældre er 5 mg pr. kg indtaget oralt to gange dagligt eller 10 mg pr. kg indtaget oralt en gang dagligt (op til et maksimum på 300 mg dagligt). administreret i kombination med andre antiretrovirale midler [se KLINISK FARMAKOLOGI ]. Overvej HIV-1 viral load og CD4+ celleantal/procentdel, når du vælger doseringsintervallet for patienter, der starter behandling med oral opløsning [se ADVARSLER OG FORHOLDSREGLER , KLINISK FARMAKOLOGI ].
Patienter med nedsat nyrefunktion
Dosering af EPIVIR 150 mg justeres i overensstemmelse med nyrefunktionen. Dosisjusteringer er angivet i tabel 2 [se KLINISK FARMAKOLOGI ].
Ingen yderligere dosering af EPIVIR 150 mg er nødvendig efter rutinemæssig (4-timers) hæmodialyse eller peritonealdialyse.
Selvom der ikke er tilstrækkelige data til at anbefale en specifik dosisjustering af EPIVIR til pædiatriske patienter med nedsat nyrefunktion, bør en reduktion af dosis og/eller en stigning i doseringsintervallet overvejes.
HVORDAN LEVERET
Doseringsformer og styrker
EPIVIR-scorede tabletter
EPIVIR tabletter med delekærv indeholder 150 mg lamivudin. Tabletterne er hvide, diamantformede, filmovertrukne tabletter med delekærv, præget med "GX CJ7" på begge sider.
EPIVIR tabletter
EPIVIR tabletter indeholder 300 mg lamivudin. Tabletterne er grå, modificeret diamantformede, filmovertrukne og indgraveret med "GX EJ7" på den ene side og almindelige på bagsiden.
EPIVIR oral opløsning
EPIVIR oral opløsning indeholder 10 mg lamivudin pr. 1 ml. Opløsningen er en klar, farveløs til lysegul væske med jordbær-banan smag.
Opbevaring og håndtering
EPIVIR tabletter med delekærv indeholder 150 mg lamivudin, er hvide, diamantformede, filmovertrukne og præget med "GX CJ7" på begge sider. Pakket som følger:
Flaske med 60 tabletter ( NDC 49702-203-18) med børnesikret lukning.
EPIVIR tabletter indeholder 300 mg lamivudin, er grå, modificeret diamantformede, filmovertrukne og indgraveret med "GX EJ7" på den ene side og almindelige på bagsiden. Pakket som følger:
Flaske med 30 tabletter ( NDC 49702-204-13) med børnesikret lukning.
Anbefalet opbevaring
Opbevar EPIVIR-tabletter ved 25°C (77°F); udflugter tilladt til 15° til 30°C (59° til 86°F) [se USP kontrolleret rumtemperatur ].
EPIVIR oral opløsning er en klar, farveløs til lysegul væske med jordbær-banan-smag. Hver ml af opløsningen indeholder 10 mg lamivudin. Pakket som følger:
Plastflaske på 240 ml (NDC 49702-205-48) med børnesikret lukning. Dette produkt kræver ikke rekonstitution.
Opbevares i tæt lukkede flasker ved 25°C (77°F) [se USP kontrolleret rumtemperatur ].
Fremstillet for: ViiV Healthcare Research Triangle Park, NC 27709. af: GlaxoSmithKline Research Triangle Park, NC 27709, Fremstillet i henhold til aftale fra Shire Pharmaceuticals Group plc. Revideret: april 2018
BIVIRKNINGER
Følgende bivirkninger er diskuteret i andre sektioner af mærkningen:
- Eksacerbationer af hepatitis B [se KASSET ADVARSEL , ADVARSLER OG FORHOLDSREGLER ].
- Laktacidose og svær hepatomegali med steatose [se ADVARSLER OG FORHOLDSREGLER ].
- Leverdekompensation hos patienter co-inficeret med HIV-1 og hepatitis C [se ADVARSLER OG FORHOLDSREGLER ].
- Pancreatitis [se ADVARSLER OG FORHOLDSREGLER ].
- Immunrekonstitutionssyndrom [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring med kliniske forsøg
Erfaring med kliniske forsøg i voksne forsøgspersoner
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med frekvenser i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke frekvenserne observeret i klinisk praksis.
Sikkerhedsprofilen for EPIVIR 150 mg hos voksne er primært baseret på 3.568 HIV-1-inficerede forsøgspersoner i 7 kliniske forsøg.
De mest almindelige bivirkninger er hovedpine, kvalme, utilpashed, træthed, nasale tegn og symptomer, diarré og hoste.
Udvalgte kliniske bivirkninger hos mere end eller lig med 5 % af forsøgspersonerne under behandling med EPIVIR 150 mg to gange dagligt plus RETROVIR 200 mg 3 gange dagligt i op til 24 uger er anført i tabel 3.
Pancreatitis
Pancreatitis blev observeret hos 9 ud af 2.613 voksne forsøgspersoner (0,3%), som fik EPIVIR 150 mg i kontrollerede kliniske forsøg EPV20001, NUCA3001, NUCB3001, NUCA3002, NUCB3002 og NUCB3007 [se ADVARSLER OG FORHOLDSREGLER ].
EPIVIR 300 mg én gang dagligt
Typerne og hyppigheden af kliniske bivirkninger rapporteret hos forsøgspersoner, der fik EPIVIR 300 mg én gang dagligt eller EPIVIR 150 mg to gange dagligt (i 3-lægemiddelkombinationsregimer i EPV20001 og EPV40001) i 48 uger var ens.
Udvalgte laboratorieabnormiteter observeret under behandlingen er opsummeret i tabel 4.
Hyppigheden af udvalgte laboratorieabnormaliteter rapporteret hos forsøgspersoner, der fik EPIVIR 300 mg én gang dagligt eller EPIVIR 150 mg to gange dagligt (i 3-lægemiddelkombinationsregimer i EPV20001 og EPV40001), var ens.
Erfaring med kliniske forsøg i pædiatriske emner
EPIVIR oral opløsning er blevet undersøgt hos 638 pædiatriske forsøgspersoner i alderen 3 måneder til 18 år i 3 kliniske forsøg.
Udvalgte kliniske bivirkninger og fysiske fund med en hyppighed på mere end eller lig med 5 % under behandling med EPIVIR 4 mg pr. kg to gange dagligt plus RETROVIR 160 mg pr. m² 3 gange dagligt i terapi-naiv (mindre end eller lig med 56 dages antiretroviral behandling) terapi) pædiatriske emner er anført i tabel 5.
Pancreatitis
Pancreatitis, som i nogle tilfælde har været dødelig, er blevet observeret hos antiretrovirale nukleosid-erfarne pædiatriske forsøgspersoner, der fik EPIVIR alene eller i kombination med andre antiretrovirale midler. I et åbent dosis-eskaleringsforsøg (NUCA2002) udviklede 14 forsøgspersoner (14%) pancreatitis, mens de modtog monoterapi med EPIVIR. Tre af disse forsøgspersoner døde af komplikationer af pancreatitis. I et andet åbent forsøg (NUCA2005) udviklede 12 forsøgspersoner (18%) pancreatitis. I forsøget med ACTG300 blev pancreatitis ikke observeret hos 236 forsøgspersoner randomiseret til EPIVIR 150 mg plus RETROVIR. Pancreatitis blev observeret hos 1 forsøgsperson i dette forsøg, som modtog åbent EPIVIR i kombination med RETROVIR og ritonavir efter seponering af didanosin-monoterapi [se ADVARSLER OG FORHOLDSREGLER ].
Paræstesier og perifere neuropatier
Paræstesier og perifere neuropatier blev rapporteret hos 15 forsøgspersoner (15 %) i forsøg NUCA2002, 6 forsøgspersoner (9 %) i forsøg NUCA2005 og 2 forsøgspersoner (mindre end 1 %) i forsøg med ACTG300.
Udvalgte laboratorieabnormiteter oplevet af terapi-naive (mindre end eller lig med 56 dages antiretroviral behandling) pædiatriske forsøgspersoner er anført i tabel 6.
Pædiatriske forsøgspersoner én gang dagligt versus dosering to gange dagligt (COL105677)
Sikkerheden ved én gang dagligt sammenlignet med to gange daglig dosering af EPIVIR 150 mg blev vurderet i ARROW forsøget. Primær sikkerhedsvurdering i ARROW-studiet var baseret på grad 3 og grad 4 bivirkninger. Hyppigheden af grad 3 og 4 bivirkninger var ens blandt forsøgspersoner, der var randomiseret til dosering én gang dagligt sammenlignet med forsøgspersoner, der var randomiseret til dosering to gange daglig. Én hændelse af grad 4 hepatitis i kohorten én gang dagligt blev betragtet som usikker kausalitet af investigator, og alle andre grad 3 eller 4 bivirkninger blev anset for ikke at være relateret af investigator.
Nyfødte
Begrænset kortsigtet sikkerhedsinformation er tilgængelig fra 2 små, ukontrollerede forsøg i Sydafrika med nyfødte, der fik lamivudin med eller uden zidovudin i den første uge af livet efter moderbehandling, der starter i uge 38 eller 36 af graviditeten [se KLINISK FARMAKOLOGI ]. Udvalgte bivirkninger rapporteret hos disse nyfødte omfattede øgede leverfunktionsprøver, anæmi, diarré, elektrolytforstyrrelser, hypoglykæmi, gulsot og hepatomegali, udslæt, luftvejsinfektioner og sepsis; 3 nyfødte døde (1 af gastroenteritis med acidose og kramper, 1 af traumatisk skade og 1 af ukendte årsager). To andre ikke-dødelige tilfælde af gastroenteritis eller diarré blev rapporteret, herunder 1 med kramper; 1 spædbarn havde forbigående nyreinsufficiens forbundet med dehydrering. Fraværet af kontrolgrupper begrænser vurderinger af kausalitet, men det bør antages, at perinatalt eksponerede spædbørn kan være i risiko for bivirkninger, der kan sammenlignes med dem, der er rapporteret hos pædiatriske og voksne HIV-1-inficerede patienter behandlet med lamivudin-holdige kombinationsregimer. Langtidsvirkninger af eksponering for lamivudin in utero og spædbørn er ikke kendt.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug af EPIVIR efter godkendelse. Fordi disse reaktioner rapporteres frivilligt fra en population af ukendt størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Disse reaktioner er blevet valgt til inklusion på grund af en kombination af deres alvor, hyppighed af rapportering eller potentielle årsagssammenhænge til lamivudin.
Kroppen som helhed
Omfordeling/akkumulering af kropsfedt.
Endokrin og metabolisk
Hyperglykæmi.
Generel
Svaghed. Hemisk og lymfatisk anæmi (herunder aplasi af ren røde blodlegemer og svær anæmi, der skrider frem under behandlingen).
Hepatisk og bugspytkirtel
Laktacidose og hepatisk steatose [se ADVARSLER OG FORHOLDSREGLER ], efterbehandling eksacerbationer af hepatitis B [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhed
Anafylaksi, nældefeber.
Muskuloskeletale
Muskelsvaghed, CPK-forhøjelse, rabdomyolyse. Hud alopeci, kløe.
DRUGSINTERAKTIONER
Lægemidler, der hæmmer organiske kationtransportører
Lamivudin elimineres overvejende i urinen ved aktiv organisk kationisk sekretion. Muligheden for interaktioner med andre lægemidler, der administreres samtidigt, bør overvejes, især når deres vigtigste eliminationsvej er aktiv nyresekretion via det organiske kationiske transportsystem (f.eks. trimethoprim) [se KLINISK FARMAKOLOGI ]. Der er ingen tilgængelige data vedrørende interaktioner med andre lægemidler, der har renale clearance-mekanismer svarende til lamivudins.
Sorbitol
Samtidig administration af enkeltdoser af lamivudin og sorbitol resulterede i en sorbitol dosisafhængig reduktion af lamivudin eksponeringen. Undgå, når det er muligt, brug af sorbitolholdige lægemidler sammen med lamivudin [se ADVARSLER OG FORHOLDSREGLER , KLINISK FARMAKOLOGI ].
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Patienter med hepatitis B virus co-infektion
Efterbehandling eksacerbationer af hepatitis
Kliniske og laboratoriemæssige tegn på eksacerbationer af hepatitis er forekommet efter seponering af lamivudin. Disse eksacerbationer er primært blevet detekteret ved serum-ALAT-stigninger ud over genfremkomst af HBV-DNA. Selvom de fleste hændelser ser ud til at have været selvbegrænsende, er dødsfald blevet rapporteret i nogle tilfælde. Lignende hændelser er blevet rapporteret fra postmarketing-erfaringer efter ændringer fra lamivudin-holdige HIV-1-behandlingsregimer til ikke-lamivudin-holdige regimer hos patienter inficeret med både HIV-1 og HBV. Årsagssammenhængen til seponering af lamivudinbehandling er ukendt. Patienter bør overvåges nøje med både klinisk og laboratorieopfølgning i mindst flere måneder efter behandlingens ophør.
Vigtige forskelle mellem Lamivudin-holdige produkter
EPIVIR 150 mg tabletter og oral opløsning indeholder en højere dosis af den samme aktive ingrediens (lamivudin) end EPIVIR-HBV tabletter og EPIVIR-HBV oral opløsning. EPIVIR-HBV blev udviklet til patienter med kronisk hepatitis B. Formuleringen og doseringen af lamivudin i EPIVIR-HBV er ikke passende til patienter co-inficeret med HIV-1 og HBV. Sikkerhed og effekt af lamivudin er ikke blevet fastslået til behandling af kronisk hepatitis B hos patienter co-inficeret med HIV-1 og HBV. Hvis behandling med EPIVIR-HBV ordineres til kronisk hepatitis B til en patient med uerkendt eller ubehandlet HIV-1-infektion, vil der sandsynligvis opstå hurtig fremkomst af HIV-1-resistens på grund af den subterapeutiske dosis og uhensigtsmæssigheden af monoterapi HIV-1-behandling. Hvis der træffes beslutning om at administrere lamivudin til patienter co-inficeret med HIV-1 og HBV, bør EPIVIR 150 mg tabletter, EPIVIR 150 mg oral opløsning eller et andet produkt, der indeholder den højere dosis lamivudin, anvendes som en del af et passende kombinationsregime.
Fremkomst af Lamivudin-resistent HBV
Sikkerhed og effekt af lamivudin er ikke blevet fastslået til behandling af kronisk hepatitis B hos personer, der er dobbelt inficeret med HIV-1 og HBV (se fuldstændig ordinationsinformation for EPIVIR-HBV). Forekomst af hepatitis B-virusvarianter forbundet med resistens over for lamivudin er også blevet rapporteret hos HIV-1-inficerede forsøgspersoner, som har fået lamivudinholdige antiretrovirale regimer i nærvær af samtidig infektion med hepatitis B-virus.
Mælkesyreacidose og svær hepatomegali med Steatose
Laktatacidose og svær hepatomegali med steatose, inklusive fatale tilfælde, er blevet rapporteret ved brug af nukleosidanaloger, inklusive EPIVIR. Et flertal af disse tilfælde har været hos kvinder. Kvindelig køn og fedme kan være risikofaktorer for udvikling af laktatacidose og svær hepatomegali med steatose hos patienter behandlet med antiretrovirale nukleosidanaloger. Behandling med EPIVIR bør suspenderes hos enhver patient, som udvikler kliniske fund eller laboratoriefund, der tyder på laktatacidose eller udtalt hepatotoksicitet, som kan omfatte hepatomegali og steatose, selv i fravær af markante transaminasestigninger.
Brug med interferon-og ribavirin-baserede regimer
In vitro undersøgelser har vist, at ribavirin kan reducere phosphoryleringen af pyrimidinnukleosidanaloger såsom lamivudin. Selvom der ikke blev set tegn på en farmakokinetisk eller farmakodynamisk interaktion (f.eks. tab af HIV-1/HCV virologisk suppression), når ribavirin blev administreret sammen med lamivudin hos HIV-1/HCV co-inficerede patienter [se KLINISK FARMAKOLOGI ], leverdekompensation (nogle dødelig) er forekommet hos HIV-1/HCV co-inficerede patienter, der modtager antiretroviral kombinationsbehandling for HIV-1 og interferon alfa med eller uden ribavirin. Patienter, der får interferon alfa med eller uden ribavirin og EPIVIR, bør monitoreres nøje for behandlingsrelaterede toksiciteter, især leverdekompensation. Seponering af EPIVIR 150 mg bør betragtes som medicinsk passende. Dosisreduktion eller seponering af interferon alfa, ribavirin eller begge bør også overvejes, hvis der observeres forværrede kliniske toksiciteter, herunder leverdekompensation (f.eks. Child-Pugh større end 6). Se den fulde ordinationsinformation for interferon og ribavirin.
Pancreatitis
Hos pædiatriske patienter med tidligere eksponering for antiretroviral nukleosid, en anamnese med pancreatitis eller andre væsentlige risikofaktorer for udvikling af pancreatitis, bør EPIVIR 150 mg anvendes med forsigtighed. Behandling med EPIVIR 150 mg skal stoppes øjeblikkeligt, hvis der opstår kliniske tegn, symptomer eller laboratorieabnormiteter, der tyder på pancreatitis [se BIVIRKNINGER ].
Immunrekonstitutionssyndrom
Immunrekonstitutionssyndrom er blevet rapporteret hos patienter behandlet med antiretroviral kombinationsbehandling, inklusive EPIVIR. Under den indledende fase af antiretroviral kombinationsbehandling kan patienter, hvis immunsystem reagerer, udvikle et inflammatorisk respons på indolente eller resterende opportunistiske infektioner (såsom Mycobacterium avium-infektion, cytomegalovirus, Pneumocystis jirovecii pneumoni [PCP] eller tuberkulose), hvilket kan nødvendiggøre yderligere evaluering og behandling.
Autoimmune lidelser (såsom Graves' sygdom, polymyositis og Guillain-Barré syndrom) er også blevet rapporteret at forekomme i forbindelse med immunrekonstitution, men tidspunktet for indtræden er mere varierende og kan forekomme mange måneder efter påbegyndelse af behandlingen.
Lavere virologisk undertrykkelse og øget risiko for viral resistens med oral opløsning
Pædiatriske forsøgspersoner, der modtog EPIVIR 150 mg oral opløsning (ved vægtbåndsbaserede doser på ca. 8 mg pr. kg pr. dag) samtidig med andre antiretrovirale orale opløsninger på et hvilket som helst tidspunkt i ARROW-studiet, havde lavere forekomst af virologisk suppression, lavere plasmaeksponering for lamivudin og udviklede viral resistens hyppigere end dem, der får EPIVIR-tabletter [se KLINISK FARMAKOLOGI , Mikrobiologi , Kliniske Studier ].
EPIVIR-tablet med delekærv er den foretrukne formulering til HIV-1-inficerede pædiatriske patienter, som vejer mindst 14 kg, og for hvem en fast dosisform er passende. Et kur, der udelukkende består af tabletter, bør anvendes, når det er muligt for at undgå en potentiel interaktion med sorbitol [se KLINISK FARMAKOLOGI ]. Overvej hyppigere monitorering af HIV-1 viral belastning ved behandling med EPIVIR 150 mg oral opløsning.
Patientrådgivningsinformation
Råd patienten til at læse den FDA-godkendte patientmærkning (patientinformation).
Patienter med hepatitis B eller C co-infektion
Informer patienter co-inficeret med HIV-1 og HBV, at forværring af leversygdom er forekommet i nogle tilfælde, når behandlingen med lamivudin blev afbrudt. Rådgiv patienterne om at diskutere eventuelle ændringer i regimen med deres læge [se ADVARSLER OG FORHOLDSREGLER ].
Informer patienter med HIV-1/HCV co-infektion om, at leverdekompensation (nogle dødelig) er forekommet hos HIV-1/HCV co-inficerede patienter, der modtager antiretroviral kombinationsbehandling for HIV-1 og interferon alfa med eller uden ribavirin [se ADVARSLER OG FORHOLDSREGLER ].
Forskelle i formuleringer af EPIVIR
Informer patienterne om, at EPIVIR 150 mg tabletter og oral opløsning indeholder en højere dosis af det samme aktive stof (lamivudin) som EPIVIR-HBV tabletter og oral opløsning. Hvis der træffes beslutning om at inkludere lamivudin i HIV-1-behandlingsregimet for en patient, der samtidig er inficeret med HIV-1 og HBV, bør formuleringen og doseringen af lamivudin i EPIVIR (ikke EPIVIR-HBV) anvendes [se ADVARSLER OG FORHOLDSREGLER ].
Mælkesyreacidose/hepatomegali med steatose
Informer patienter om, at laktatacidose og svær hepatomegali med steatose er blevet rapporteret ved brug af nukleosidanaloger og andre antiretrovirale midler. Rådgive patienter om at stoppe med at tage EPIVIR, hvis de udvikler kliniske symptomer, der tyder på laktatacidose eller udtalt levertoksicitet [se ADVARSLER OG FORHOLDSREGLER ].
Risiko for pancreatitis
Rådgiv forældre eller værger om at overvåge pædiatriske patienter for tegn og symptomer på pancreatitis [se ADVARSLER OG FORHOLDSREGLER ].
Immunrekonstitutionssyndrom
Rådgiv patienter om straks at informere deres læge om tegn og symptomer på infektion, da betændelse fra tidligere infektion kan opstå kort efter antiretroviral kombinationsbehandling, herunder når EPIVIR startes [se ADVARSLER OG FORHOLDSREGLER ].
Lavere virologisk undertrykkelse og øget risiko for viral resistens med oral opløsning
Rådgiv patienterne om, at en kur, der udelukkende består af tabletter, bør anvendes, når det er muligt på grund af en øget frekvens af behandlingssvigt blandt pædiatriske forsøgspersoner, som fik EPIVIR oral opløsning samtidig med andre antiretrovirale orale opløsninger [se ADVARSLER OG FORHOLDSREGLER ].
Saccharoseindhold i EPIVIR oral opløsning
Råd til diabetespatienter om, at hver 15 ml dosis af EPIVIR oral opløsning indeholder 3 gram saccharose (1 ml = 200 mg saccharose) [se BESKRIVELSE ].
Graviditetsregister
Rådgiv patienterne om, at der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er udsat for EPIVIR under graviditeten [se Brug i specifikke populationer ].
Amning
Instruer kvinder med HIV-1-infektion i ikke at amme, fordi HIV-1 kan overføres til barnet i modermælken [se Brug i specifikke populationer ].
Glemt dosering
Instruer patienterne i, at de skal tage den, så snart de kommer i tanke om det, hvis de glemmer en dosis EPIVIR 150 mg. Advis patienter til ikke at fordoble deres næste dosis eller tage mere end den ordinerede dosis [se DOSERING OG ADMINISTRATION ].
EPIVIR og RETROVIR er varemærker ejet af eller licenseret til ViiV Healthcare-gruppen af virksomheder.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Langtidskarcinogenicitetsundersøgelser med lamivudin hos mus og rotter viste ingen tegn på karcinogenicitet ved eksponeringer op til 10 gange (mus) og 58 gange (rotter) den humane eksponering ved den anbefalede dosis på 300 mg.
Mutagenese
Lamivudin var mutagent i en L5178Y muselymfomanalyse og klastogen i et cytogenetisk assay med dyrkede humane lymfocytter. Lamivudin var ikke mutagent i et mikrobielt mutagenicitetsassay, i et in vitro celletransformationsassay, i en rotte mikronukleustest, i en rotteknoglemarvscytogenetisk assay og i et assay for ikke-planlagt DNA-syntese i rottelever. Lamivudin viste ingen tegn på in vivo genotoksisk aktivitet hos rotter ved orale doser på op til 2.000 mg pr. kg, hvilket gav plasmaniveauer på 35 til 45 gange dem hos mennesker ved den anbefalede dosis til HIV-1-infektion.
Forringelse af fertilitet
I en undersøgelse af reproduktionsevnen afslørede lamivudin administreret til rotter i doser på op til 4.000 mg pr. kg pr. dag, hvilket producerede plasmaniveauer 47 til 70 gange dem hos mennesker, ingen tegn på nedsat fertilitet og ingen effekt på overlevelse, vækst og udvikling. til fravænning af afkommet.
Brug i specifikke populationer
Graviditet
Graviditetseksponeringsregister
Der er et graviditetseksponeringsregister, der overvåger graviditetsresultater hos kvinder, der er eksponeret for EPIVIR under graviditet. Sundhedsudbydere opfordres til at registrere patienter ved at ringe til Antiretroviral Pregnancy Registry (APR) på 1-800-258-4263.
Risikooversigt
Tilgængelige data fra ÅOP viser ingen forskel i den samlede risiko for fødselsdefekter for lamivudin sammenlignet med baggrundsraten for fødselsdefekter på 2,7 % i referencepopulationen Metropolitan Atlanta Congenital Defects Program (MACDP) (se Data ). ÅOP bruger MACDP som den amerikanske referencepopulation for fødselsdefekter i den generelle befolkning. MACDP evaluerer kvinder og spædbørn fra et begrænset geografisk område og inkluderer ikke resultater for fødsler, der fandt sted ved mindre end 20 ugers svangerskab. Hyppigheden af abort er ikke rapporteret i ÅOP. Den estimerede baggrundsrate for abort i klinisk anerkendte graviditeter i den generelle befolkning i USA er 15 % til 20 %. Baggrundsrisikoen for alvorlige fødselsdefekter og abort for den angivne population er ukendt.
I reproduktionsstudier på dyr resulterede oral administration af lamivudin til drægtige kaniner under organogenese i embryodødelighed ved systemisk eksponering (AUC) svarende til den anbefalede kliniske dosis; der blev dog ikke observeret uønskede udviklingseffekter ved oral administration af lamivudin til drægtige rotter under organogenese ved plasmakoncentrationer (Cmax) 35 gange den anbefalede kliniske dosis (se Data ).
Data
Menneskelige data
Baseret på prospektive indberetninger til ÅOP for over 11.000 eksponeringer for lamivudin under graviditet, hvilket resulterede i levende fødsler (inklusive over 4.500 eksponerede i første trimester), var der ingen forskel mellem den samlede risiko for fødselsdefekter for lamivudin sammenlignet med antallet af fødselsdefekter i baggrunden på 2,7 % i den amerikanske referencepopulation af MACDP. Prævalensen af defekter i levende fødte var 3,1 % (95 % CI: 2,6 % til 3,6 %) efter eksponering i første trimester for regimer indeholdende lamivudin og 2,8 % (95 % CI: 2,5 % til 3,3 %) efter eksponering i andet/tredje trimester til regimer indeholdende lamivudin.
Lamivudins farmakokinetik blev undersøgt hos gravide kvinder under 2 kliniske forsøg udført i Sydafrika. Forsøgene vurderede farmakokinetikken hos 16 kvinder ved 36 ugers svangerskab, der brugte 150 mg lamivudin to gange dagligt med zidovudin, 10 kvinder ved 38 ugers graviditet, der brugte 150 mg lamivudin to gange dagligt med zidovudin, og 10 kvinder ved 38 ugers 38. dagligt uden andre antiretrovirale midler. Disse forsøg var ikke designet eller drevet til at give information om effektivitet. Lamivudinkoncentrationerne var generelt ens i serumprøver fra moderen, neonatal og navlestreng. Hos en undergruppe af forsøgspersoner blev der udtaget fostervandsprøver efter naturligt brud på membraner og bekræftet, at lamivudin krydser placenta hos mennesker. Baseret på begrænsede data ved fødslen var median (interval) fostervandskoncentrationer af lamivudin 3,9 (1,2 til 12,8) gange større sammenlignet med parret maternal serumkoncentration (n = 8).
Dyredata
Lamivudin blev givet oralt til gravide rotter (90, 600 og 4.000 mg pr. kg pr. dag) og kaniner (ved 90, 300 og 1.000 mg pr. kg pr. dag og 15, 40 og 90 mg pr. kg pr. dag) under organogenese (på drægtighedsdage 7 til 16 [rotte] og 8 til 20 [kanin]). Der blev ikke observeret tegn på føtale misdannelser på grund af lamivudin hos rotter og kaniner ved doser, der producerede plasmakoncentrationer (Cmax) ca. 35 gange højere end human eksponering ved den anbefalede daglige dosis. Der blev set tegn på tidlig embryodødelighed hos kanin ved systemeksponeringer (AUC) svarende til dem, der blev observeret hos mennesker, men der var ingen indikation af denne effekt hos rotter ved plasmakoncentrationer (Cmax) 35 gange højere end human eksponering ved den anbefalede daglige dosis . Undersøgelser med gravide rotter viste, at lamivudin overføres til fosteret gennem placenta. I fertilitets-/præ- og postnatal udviklingsstudiet hos rotter blev lamivudin administreret oralt i doser på 180, 900 og 4.000 mg pr. kg pr. dag (fra før parring til postnatal dag 20). I undersøgelsen blev udviklingen af afkommet, inklusive fertilitet og reproduktionsevne, ikke påvirket af moderens administration af lamivudin.
Amning
Risikooversigt
Centers for Disease Control and Prevention anbefaler, at HIV-1-inficerede mødre i USA ikke ammer deres spædbørn for at undgå at risikere postnatal overførsel af HIV-1-infektion. Lamivudin findes i modermælk. Der er ingen information om virkningerne af lamivudin på det ammede spædbarn eller stoffernes virkning på mælkeproduktionen. På grund af potentialet for (1) HIV-1-overførsel (hos HIV-negative spædbørn), (2) udvikling af viral resistens (hos HIV-positive spædbørn) og (3) bivirkninger hos et ammende spædbarn, instruer mødre i ikke at amme hvis de modtager EPIVIR.
Pædiatrisk brug
Sikkerheden og effektiviteten af EPIVIR 150 mg i kombination med andre antiretrovirale midler er blevet fastslået hos pædiatriske patienter i alderen 3 måneder og ældre. EPIVIR-tablet er den foretrukne formulering til HIV-1-inficerede pædiatriske patienter, der vejer mindst 14 kg, og for hvem en fast dosisform er passende, fordi pædiatriske forsøgspersoner, der fik EPIVIR 150 mg oral opløsning, havde lavere forekomst af virologisk suppression, lavere plasmaeksponering for lamivudin , og udviklede virusresistens hyppigere end dem, der fik EPIVIR 150 mg tabletter i ARROW-forsøget [se DOSERING OG ADMINISTRATION , ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , KLINISK FARMAKOLOGI , Kliniske Studier ].
Geriatrisk brug
Kliniske forsøg med EPIVIR omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner. Generelt bør der udvises forsigtighed ved administration af EPIVIR til ældre patienter, hvilket afspejler den større hyppighed af nedsat lever-, nyre- eller hjertefunktion og af samtidig sygdom eller anden lægemiddelbehandling [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
Patienter med nedsat nyrefunktion
Reduktion af dosis af EPIVIR 150 mg anbefales til patienter med nedsat nyrefunktion [se DOSERING OG ADMINISTRATION , KLINISK FARMAKOLOGI ].
OVERDOSIS
Der er ingen kendt specifik behandling for overdosering med EPIVIR. Hvis der opstår overdosering, skal patienten overvåges og standardstøttende behandling anvendes efter behov. Da en ubetydelig mængde lamivudin blev fjernet via (4-timers) hæmodialyse, kontinuerlig ambulatorisk peritonealdialyse og automatiseret peritonealdialyse, vides det ikke, om kontinuerlig hæmodialyse ville give kliniske fordele ved en lamivudin-overdosis.
KONTRAINDIKATIONER
EPIVIR 150 mg er kontraindiceret til patienter med en tidligere overfølsomhedsreaktion over for lamivudin.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Lamivudin er et antiretroviralt middel [se Mikrobiologi ].
Farmakokinetik
Farmakokinetik hos voksne
De farmakokinetiske egenskaber af lamivudin er blevet undersøgt hos asymptomatiske, HIV-1-inficerede voksne forsøgspersoner efter administration af enkelt intravenøse (IV) doser i området fra 0,25 til 8 mg pr. kg, såvel som enkelte og multiple (to gange dagligt) orale doser spænder fra 0,25 til 10 mg pr. kg.
De farmakokinetiske egenskaber af lamivudin er også blevet undersøgt som enkelte og multiple orale doser i området fra 5 mg til 600 mg dagligt administreret til HBV-inficerede forsøgspersoner.
De farmakokinetiske steady-state egenskaber af EPIVIR 300 mg tabletten én gang dagligt i 7 dage sammenlignet med EPIVIR 150 mg tabletten to gange dagligt i 7 dage blev vurderet i et crossover forsøg med 60 raske forsøgspersoner. EPIVIR 300 mg én gang dagligt resulterede i lamivudineksponeringer, der svarede til EPIVIR 150 mg to gange dagligt med hensyn til plasma AUC24,ss; Cmax,ss var imidlertid 66 % højere, og bundværdien var 53 % lavere sammenlignet med 150 mg to gange dagligt. Intracellulær eksponering af lamivudintriphosphat i mononukleære celler i perifert blod var også ens med hensyn til AUC24,ss og Cmax24,ss; dog var bundværdierne lavere sammenlignet med 150 mg to gange dagligt. Inter-individ variabiliteten var større for intracellulære lamivudintriphosphatkoncentrationer versus lamivudin plasma-dalkoncentrationer.
Lamivudins farmakokinetik blev evalueret hos 12 voksne HIV-1-inficerede forsøgspersoner doseret med lamivudin 150 mg to gange dagligt i kombination med andre antiretrovirale midler. Det geometriske middelværdi (95 % CI) for AUC(0-12) var 5,53 (4,58, 6,67) mcg.t pr. ml og for Cmax var 1,40 (1,17, 1,69) mcg pr. ml.
Absorption og biotilgængelighed
Absolut biotilgængelighed hos 12 voksne forsøgspersoner var 86 % ± 16 % (gennemsnit ± SD) for 150 mg tabletten og 87 % ± 13 % for den orale opløsning. Efter oral administration af 2 mg pr. kg to gange dagligt til 9 voksne med HIV-1 var den maksimale serumkoncentration af lamivudin (Cmax) 1,5 ± 0,5 mcg pr. ml (gennemsnit ± SD). Arealet under kurven for plasmakoncentration versus tid (AUC) og Cmax steg i forhold til oral dosis i området fra 0,25 til 10 mg pr. kg.
Akkumuleringsraten for lamivudin hos HIV-1-positive asymptomatiske voksne med normal nyrefunktion var 1,50 efter 15 dages oral administration af 2 mg pr. kg to gange dagligt.
Virkninger af mad på oral absorption
EPIVIR 150 mg tabletter og oral opløsning kan indgives med eller uden mad. En forsøgsdosis på 25 mg af lamivudin blev administreret oralt til 12 asymptomatiske, HIV-1-inficerede forsøgspersoner ved 2 lejligheder, én gang i fastende tilstand og én gang med mad (1.099 kcal; 75 gram fedt, 34 gram protein, 72 gram kulhydrat ). Absorptionen af lamivudin var langsommere i fødetilstand (Tmax: 3,2 ± 1,3 timer) sammenlignet med den fastende tilstand (Tmax: 0,9 ± 0,3 timer); Cmax i fødetilstand var 40 % ± 23 % (gennemsnit ± SD) lavere end i fastende tilstand. Der var ingen signifikant forskel i systemisk eksponering (AUC∞) i føde- og fastende tilstand.
Fordeling
Det tilsyneladende distributionsvolumen efter IV administration af lamivudin til 20 forsøgspersoner var 1,3 ± 0,4 l pr. kg, hvilket tyder på, at lamivudin fordeler sig i ekstravaskulære rum. Fordelingsvolumen var uafhængig af dosis og korrelerede ikke med kropsvægt.
Bindingen af lamivudin til humane plasmaproteiner er mindre end 36 %. In vitro undersøgelser viste, at over koncentrationsområdet på 0,1 til 100 mcg pr. ml varierede mængden af lamivudin forbundet med erytrocytter fra 53 % til 57 % og var uafhængig af koncentrationen.
Metabolisme
Metabolisme af lamivudin er en mindre eliminationsvej. Hos mennesker er den eneste kendte metabolit af lamivudin transsulfoxidmetabolitten (ca. 5 % af en oral dosis efter 12 timer). Serumkoncentrationer af denne metabolit er ikke blevet bestemt. Lamivudin metaboliseres ikke signifikant af cytochrom P450-enzymer.
Elimination
Størstedelen af lamivudin elimineres uændret i urinen ved aktiv organisk kationisk sekretion. Hos 9 raske forsøgspersoner, der fik en enkelt 300 mg oral dosis lamivudin, var renal clearance 199,7 ± 56,9 ml pr. min (gennemsnit ± SD). Hos 20 HIV-1-inficerede forsøgspersoner, der fik en enkelt IV-dosis, var renal clearance 280,4 ± 75,2 ml pr. min (gennemsnit ± SD), hvilket repræsenterer 71 % ± 16 % (gennemsnit ± SD) af total clearance af lamivudin.
I de fleste enkeltdosisforsøg med HIV-1-inficerede forsøgspersoner, HBV-inficerede forsøgspersoner eller raske forsøgspersoner med serumprøvetagning i 24 timer efter dosering, varierede den observerede gennemsnitlige eliminationshalveringstid (t½) fra 5 til 7 timer. Hos HIV-1-inficerede forsøgspersoner var total clearance 398,5 ± 69,1 ml pr. min (gennemsnit ± SD). Oral clearance og eliminationshalveringstid var uafhængig af dosis og kropsvægt over et oralt doseringsområde på 0,25 til 10 mg pr. kg.
Specifikke populationer
Patienter med nedsat nyrefunktion
De farmakokinetiske egenskaber af lamivudin er blevet bestemt hos en lille gruppe HIV-1-inficerede voksne med nedsat nyrefunktion (tabel 7).
Tmax var ikke signifikant påvirket af nyrefunktionen. Baseret på disse observationer anbefales det, at dosis af lamivudin ændres hos patienter med nedsat nyrefunktion [se DOSERING OG ADMINISTRATION ].
Baseret på et forsøg med ellers raske forsøgspersoner med nedsat nyrefunktion, øgede hæmodialyse lamivudinclearance fra et gennemsnit på 64 til 88 ml pr. min; varigheden af hæmodialyse (4 timer) var imidlertid utilstrækkelig til signifikant at ændre den gennemsnitlige eksponering for lamivudin efter en enkeltdosis administration. Kontinuerlig ambulatorisk peritonealdialyse og automatiseret peritonealdialyse har ubetydelig effekt på lamivudin-clearance. Det anbefales derfor, efter korrektion af dosis for kreatininclearance, at der ikke foretages yderligere dosisændringer efter rutinemæssig hæmodialyse eller peritonealdialyse.
Virkningerne af nedsat nyrefunktion på lamivudins farmakokinetik hos pædiatriske patienter kendes ikke.
Patienter med nedsat leverfunktion
De farmakokinetiske egenskaber af lamivudin er blevet bestemt hos voksne med nedsat leverfunktion. Farmakokinetiske parametre blev ikke ændret af nedsat leverfunktion. Sikkerhed og effekt af lamivudin er ikke blevet fastslået ved tilstedeværelse af dekompenseret leversygdom.
Gravid kvinde
Lamivudins farmakokinetik blev undersøgt hos 36 gravide kvinder under 2 kliniske forsøg udført i Sydafrika. Lamivudins farmakokinetik hos gravide kvinder svarede til dem, der ses hos ikke-gravide voksne og hos postpartum kvinder. Lamivudinkoncentrationerne var generelt ens i serumprøver fra moderen, neonatal og navlestreng.
Pædiatriske patienter
Lamivudins farmakokinetik er blevet undersøgt efter enten enkelt- eller gentagne doser af EPIVIR hos 210 pædiatriske forsøgspersoner. Pædiatriske forsøgspersoner, der fik lamivudin oral opløsning (doseret med ca. 8 mg pr. kg pr. dag) opnåede ca. 25 % lavere plasmakoncentrationer af lamivudin sammenlignet med HIV-1-inficerede voksne. Pædiatriske forsøgspersoner, der fik lamivudin orale tabletter, opnåede plasmakoncentrationer, der var sammenlignelige med eller lidt højere end dem, der blev observeret hos voksne. Den absolutte biotilgængelighed af både EPIVIR-tabletter og oral opløsning er lavere hos børn end hos voksne. Den relative biotilgængelighed af EPIVIR oral opløsning er ca. 40 % lavere end tabletter indeholdende lamivudin hos pædiatriske forsøgspersoner på trods af ingen forskel hos voksne. Lavere eksponeringer for lamivudin hos pædiatriske patienter, der får EPIVIR 150 mg oral opløsning, skyldes sandsynligvis interaktionen mellem lamivudin og samtidige opløsninger, der indeholder sorbitol (såsom ZIAGEN). Modellering af farmakokinetiske data tyder på, at det er nødvendigt at øge dosis af EPIVIR oral opløsning til 5 mg pr. kg indtaget oralt to gange dagligt eller 10 mg pr. kg indtaget oralt en gang dagligt (op til et maksimum på 300 mg dagligt) for at opnå tilstrækkelige koncentrationer af lamivudin [se DOSERING OG ADMINISTRATION ]. Der er ingen kliniske data for HIV-1-inficerede pædiatriske patienter, der samtidig administreres med sorbitolholdige lægemidler i denne dosis.
Farmakokinetikken af lamivudin doseret én gang dagligt til HIV-1-inficerede pædiatriske forsøgspersoner i alderen 3 måneder til 12 år blev evalueret i 3 forsøg (PENTA-15 [n = 17], PENTA 13 [n = 19] og ARROW PK [n = 35]). Alle 3 forsøg var 2-perioders, crossover, åbne farmakokinetiske forsøg med to gange versus én gang daglig dosering af abacavir og lamivudin. Disse 3 forsøg viste, at dosering én gang dagligt giver tilsvarende AUC0-24 til dosering to gange daglig af lamivudin ved den samme samlede daglige dosis, når man sammenligner doseringsregimerne i den samme formulering (dvs. enten den orale opløsning eller tabletformuleringen). Den gennemsnitlige Cmax var ca. 80 % til 90 % højere med lamivudin én gang dagligt sammenlignet med to gange dagligt.
Fordeling af lamivudin til cerebrospinalvæske (CSF) blev vurderet hos 38 pædiatriske forsøgspersoner efter flere orale doseringer med lamivudin. CSF-prøver blev opsamlet mellem 2 og 4 timer efter dosis. Ved en dosis på 8 mg pr. kg pr. dag varierede koncentrationen af CSF-lamivudin hos 8 forsøgspersoner fra 5,6 % til 30,9 % (gennemsnit ± SD på 14,2 % ± 7,9 %) af koncentrationen i en samtidig serumprøve, med CSF-lamivudinkoncentrationer i området fra 0,04 til 0,3 mcg pr. ml.
Begrænsede, ukontrollerede farmakokinetiske data og sikkerhedsdata er tilgængelige fra administration af lamivudin (og zidovudin) til 36 spædbørn i alderen op til 1 uge i 2 forsøg i Sydafrika. I disse forsøg var lamivudin-clearance væsentligt reduceret hos 1 uge gamle nyfødte i forhold til tidligere undersøgte pædiatriske forsøgspersoner (i alderen over 3 måneder). Der er utilstrækkelig information til at fastslå tidsforløbet for ændringer i clearance mellem den umiddelbare neonatale periode og aldersgrupperne over 3 måneder gamle [se BIVIRKNINGER ].
Geriatriske patienter
Farmakokinetikken af lamivudin efter administration af EPIVIR 150 mg til personer over 65 år er ikke blevet undersøgt [se Brug i specifikke populationer ].
Mandlige og kvindelige patienter
Der er ingen signifikante eller klinisk relevante kønsforskelle i lamivudins farmakokinetik.
Racegrupper
Der er ingen signifikante eller klinisk relevante raceforskelle i lamivudins farmakokinetik.
Lægemiddelinteraktionsstudier
Virkning af Lamivudin på farmakokinetikken af andre midler
Baseret på in vitro undersøgelsesresultater forventes lamivudin ved terapeutiske lægemiddeleksponeringer ikke at påvirke farmakokinetikken af lægemidler, der er substrater for følgende transportører: organisk aniontransportørpolypeptid 1B1/3 (OATP1B1/3), brystkræftresistensprotein (BCRP), P-glykoprotein (P-gp), multilægemiddel- og toksinekstruderingsprotein 1 (MATE)1, MATE2-K, organisk kationtransportør 1 (OCT)1, OCT2 eller OCT3.
Virkning af andre midler på Lamivudins farmakokinetik
Lamivudin er et substrat for MATE1, MATE2-K og OCT2 in vitro. Trimethoprim (en hæmmer af disse lægemiddeltransportere) har vist sig at øge plasmakoncentrationen af lamivudin. Denne interaktion anses ikke for at være klinisk signifikant, da dosisjustering af lamivudin ikke er nødvendig.
Lamivudin er et substrat af P-gp og BCRP; I betragtning af dets absolutte biotilgængelighed (87%) er det imidlertid usandsynligt, at disse transportører spiller en signifikant rolle i absorptionen af lamivudin. Derfor er det usandsynligt, at samtidig administration af lægemidler, der hæmmer disse effluxtransportører, vil påvirke dispositionen og elimineringen af lamivudin.
Interferon Alfa
Der var ingen signifikant farmakokinetisk interaktion mellem lamivudin og interferon alfa i et forsøg med 19 raske mandlige forsøgspersoner [se ADVARSLER OG FORHOLDSREGLER ].
Ribavirin
In vitro-data indikerer, at ribavirin reducerer fosforylering af lamivudin, stavudin og zidovudin. Der blev dog ikke observeret nogen farmakokinetisk (f.eks. plasmakoncentrationer eller intracellulære triphosphorylerede aktive metabolitkoncentrationer) eller farmakodynamiske (f.eks. tab af HIV-1/HCV virologisk suppression) interaktion, når ribavirin og lamivudin (n = 18), stavudin (n = 10) , eller zidovudin (n = 6) blev administreret samtidigt som en del af et multilægemiddelregime til HIV-1/HCV co-inficerede forsøgspersoner [se ADVARSLER OG FORHOLDSREGLER ].
Sorbitol (hjælpestof)
Lamivudin og sorbitol-opløsninger blev administreret samtidigt til 16 raske voksne forsøgspersoner i et åbent, randomiseret sekvens, 4-perioders crossover-forsøg. Hvert individ modtog en enkelt dosis på 300 mg lamivudin oral opløsning alene eller sammen med en enkelt dosis på 3,2 gram, 10,2 gram eller 13,4 gram sorbitol i opløsning. Samtidig administration af lamivudin og sorbitol resulterede i dosisafhængige fald på 20 %, 39 % og 44 % i AUC(0-24), 14 %, 32 % og 36 % i AUC(∞) og 28 %. 52 % og 55 % i Cmax; af henholdsvis lamivudin.
Trimethoprim/Sulfamethoxazol
Lamivudin og TMP/SMX blev administreret samtidigt til 14 HIV-1-positive forsøgspersoner i et enkeltcenter, åbent, randomiseret, crossover-forsøg. Hvert individ modtog behandling med en enkelt 300 mg dosis lamivudin og TMP 160 mg/SMX 800 mg én gang dagligt i 5 dage med samtidig administration af lamivudin 300 mg med den femte dosis i et crossover-design. Samtidig administration af TMP/SMX med lamivudin resulterede i en stigning på 43 % ± 23 % (gennemsnit ± SD) i lamivudin AUC∞, et fald på 29 % ± 13 % i lamivudin oral clearance og et fald på 30 % ± 36 % i lamivudin renal clearance. De farmakokinetiske egenskaber af TMP og SMX blev ikke ændret ved samtidig administration med lamivudin. Der er ingen information om virkningen på lamivudins farmakokinetik af højere doser af TMP/SMX, såsom dem, der anvendes til behandling af PCP.
Zidovudin
Der blev ikke observeret nogen klinisk signifikante ændringer i lamivudins eller zidovudins farmakokinetik hos 12 asymptomatiske HIV-1-inficerede voksne forsøgspersoner, der fik en enkelt dosis zidovudin (200 mg) i kombination med flere doser lamivudin (300 mg hver 12. time).
Mikrobiologi
Handlingsmekanisme
Lamivudin er en syntetisk nukleosidanalog. Intracellulært phosphoryleres lamivudin til dets aktive 5'-triphosphatmetabolit, lamivudintriphosphat (3TC-TP). Den primære virkemåde for 3TC-TP er inhibering af HIV-1 revers transkriptase (RT) via DNA-kædeterminering efter inkorporering af nukleotidanalogen.
Antiviral aktivitet
Den antivirale aktivitet af lamivudin mod HIV-1 blev vurderet i en række cellelinjer, herunder monocytter og friske humane perifere blodlymfocytter (PBMC'er) ved brug af standardfølsomhedsassays. EC50-værdier lå i området fra 0,003 til 15 mikroM (1 mikroM = 0,23 mikrogram pr. ml). Median-EC50-værdierne for lamivudin var 60 nM (interval: 20 til 70 nM), 35 nM (interval: 30 til 40 nM), 30 nM (interval: 20 til 90 nM), 20 nM (interval: 3 til 40 nM) 30 nM (område: 1 til 60 nM), 30 nM (område: 20 til 70 nM), 30 nM (område: 3 til 70 nM) og 30 nM (område: 20 til 90 nM) mod HIV-1-klader AG- og gruppe O-vira (n = 3 undtagen n = 2 for klasse B). EC50-værdierne mod HIV-2-isolater (n = 4) varierede fra 0,003 til 0,120 mikroM i PBMC'er. Lamivudin var ikke antagonistisk over for alle testede anti-HIV-midler. Ribavirin (50 mikroM) anvendt til behandling af kronisk HCV-infektion reducerede anti-HIV-1-aktiviteten af lamivudin med 3,5 gange i MT-4-celler.
Modstand
Lamivudin-resistente varianter af HIV-1 er blevet udvalgt i cellekultur. Genotypisk analyse viste, at resistensen skyldtes en specifik aminosyresubstitution i HIV-1 revers transkriptase ved codon 184, der ændrede methioninen til enten valin eller isoleucin (M184V/I).
HIV-1-stammer, der er resistente over for både lamivudin og zidovudin, er blevet isoleret fra forsøgspersoner. Kliniske isolaters følsomhed over for lamivudin og zidovudin blev overvåget i kontrollerede kliniske forsøg. Hos forsøgspersoner, der fik lamivudin monoterapi eller kombinationsbehandling med lamivudin plus zidovudin, blev HIV-1-isolater fra de fleste forsøgspersoner fænotypisk og genotypisk resistente over for lamivudin inden for 12 uger.
Genotypisk og fænotypisk analyse af HIV-1-isolater under behandling fra forsøgspersoner med virologisk svigt
Prøve EPV20001
Treoghalvtreds af 554 (10%) forsøgspersoner indskrevet i EPV20001 blev identificeret som virologiske svigt (plasma HIV-1 RNA niveau større end eller lig med 400 kopier pr. ml) i uge 48. Otteogtyve forsøgspersoner blev randomiseret til lamivudin én gang- daglig behandlingsgruppe og 25 til lamivudin behandlingsgruppen to gange dagligt. Median baseline plasma HIV-1 RNA niveauer for forsøgspersoner i gruppen lamivudin én gang dagligt og lamivudin to gange dagligt var henholdsvis 4,9 log10 kopier pr. ml og 4,6 log10 kopier pr. ml.
Genotypisk analyse af isolater i behandling fra 22 forsøgspersoner identificeret som virologiske svigt i gruppen lamivudin én gang dagligt viste, at isolater fra 8 ud af 22 forsøgspersoner indeholdt en behandlingsfremkaldt lamivudinresistens-associeret substitution (M184V eller M184I), isolater fra 0 af 22 forsøgspersoner indeholdt behandlingsfremkomne aminosyresubstitutioner forbundet med zidovudinresistens (M41L, D67N, K70R, L210W, T215Y/F eller K219Q/E), og isolater fra 10 ud af 22 forsøgspersoner indeholdt behandlingsfremkomne aminosyresubstitutioner forbundet med efavirenzresistens ( L100I, K101E, K103N, V108I eller Y181C).
Genotypisk analyse af isolater i behandling fra forsøgspersoner (n = 22) i lamivudin-behandlingsgruppen to gange dagligt viste, at isolater fra 5 ud af 22 forsøgspersoner indeholdt behandlingsfremkomne lamivudin-resistenssubstitutioner, isolater fra 1 ud af 22 forsøgspersoner indeholdt behandlings-emergent zidovudinresistens substitutioner og isolater fra 7 ud af 22 forsøgspersoner indeholdt behandlingsfremkaldte efavirenz-resistenssubstitutioner.
Fænotypisk analyse af baseline-matchede HIV-1-isolater i behandling fra forsøgspersoner (n = 13), der fik lamivudin én gang dagligt, viste, at isolater fra 7 ud af 13 forsøgspersoner viste et 85- til 299-fold fald i modtagelighed for lamivudin, isolater fra 12 af 13 forsøgspersoner var modtagelige for zidovudin, og isolater fra 8 ud af 13 forsøgspersoner udviste et 25- til 295-fold fald i følsomhed over for efavirenz.
Fænotypisk analyse af baseline-matchede HIV-1-isolater i behandling fra forsøgspersoner (n = 13), der fik lamivudin to gange dagligt, viste, at isolater fra 4 ud af 13 forsøgspersoner udviste et 29- til 159-fold fald i modtagelighed for lamivudin, isolater fra alle 13. forsøgspersonerne var modtagelige for zidovudin, og isolater fra 3 ud af 13 forsøgspersoner udviste et 21- til 342-fold fald i følsomhed over for efavirenz.
Prøveversion EPV40001
50 forsøgspersoner fik lamivudin 300 mg én gang dagligt plus zidovudin 300 mg to gange dagligt plus abacavir 300 mg to gange dagligt, og 50 forsøgspersoner fik lamivudin 150 mg plus zidovudin 300 mg plus abacavir 300 mg alle to gange dagligt. Median baseline plasma HIV-1 RNA niveauer for forsøgspersoner i de 2 grupper var henholdsvis 4,79 log10 kopier pr. ml og 4,83 log10 kopier pr. ml. Fjorten ud af 50 forsøgspersoner i gruppen med lamivudin én gang dagligt og 9 ud af 50 forsøgspersoner i gruppen med lamivudin to gange dagligt blev identificeret som virologiske svigt.
Genotypisk analyse af HIV-1-isolater i behandling fra forsøgspersoner (n = 9) i lamivudin-behandlingsgruppen én gang dagligt viste, at isolater fra 6 forsøgspersoner havde en abacavir- og/eller lamivudinresistens-associeret substitution M184V alene. Isolater i behandling fra forsøgspersoner (n = 6), der fik lamivudin to gange dagligt, viste, at isolater fra 2 forsøgspersoner havde M184V alene, og isolater fra 2 forsøgspersoner havde M184V-substitutionen i kombination med zidovudinresistens-associerede aminosyresubstitutioner.
Fænotypisk analyse af isolater i behandling fra forsøgspersoner (n = 6), der fik lamivudin én gang dagligt, viste, at HIV-1-isolater fra 4 forsøgspersoner udviste et 32- til 53-fold fald i modtagelighed for lamivudin. HIV-1-isolater fra disse 6 forsøgspersoner var modtagelige for zidovudin.
Fænotypisk analyse af isolater i behandling fra forsøgspersoner (n = 4), der fik lamivudin to gange dagligt, viste, at HIV-1-isolater fra 1 forsøgsperson udviste et 45-fold fald i følsomhed over for lamivudin og et 4,5-fold fald i følsomhed over for zidovudin.
Pædiatri
Pædiatriske forsøgspersoner, der fik lamivudin oral opløsning samtidig med andre antiretrovirale orale opløsninger (abacavir, nevirapin/efavirenz eller zidovudin) i ARROW udviklede hyppigere viral resistens end dem, der fik tabletter. Ved randomisering til én eller to gange daglig dosering af EPIVIR plus abacavir havde 13 % af forsøgspersonerne, der startede på tabletter, og 32 % af forsøgspersonerne, der startede på opløsning, resistenssubstitutioner. Resistensprofilen, der er observeret i pædiatri, svarer til den, der er observeret hos voksne med hensyn til de påviste genotypiske substitutioner og relativ hyppighed, med de mest almindeligt påviste substitutioner ved M184 (V eller I) [se Kliniske Studier ].
Krydsmodstand
Krydsresistens er blevet observeret blandt nukleosid revers transkriptasehæmmere (NRTI'er). Lamivudin-resistente HIV-1-mutanter var krydsresistente i cellekultur over for didanosin (ddI). Krydsresistens forventes også med abacavir og emtricitabin, da disse udvalgte M184V-substitutioner.
Kliniske Studier
Anvendelsen af EPIVIR er baseret på resultaterne af kliniske forsøg med HIV-1-inficerede personer i kombinationsregimer med andre antiretrovirale midler. Oplysninger fra forsøg med kliniske endepunkter eller en kombination af CD4+-celletal og HIV-1 RNA-målinger er inkluderet nedenfor som dokumentation for lamivudins bidrag til et kombinationsregime i kontrollerede forsøg.
Voksne emner
Klinisk endepunktsforsøg
NUCB3007 (CAESAR) var et multicenter, dobbeltblindt, placebokontrolleret forsøg, der sammenlignede fortsat nuværende behandling (zidovudin alene [62 % af forsøgspersonerne] eller zidovudin med didanosin eller zalcitabin [38 % af forsøgspersonerne]) med tilsætning af EPIVIR 150 mg eller EPIVIR 150 mg plus en ikke-nukleosid revers transkriptasehæmmer (NNRTI), randomiseret 1:2:1. I alt 1.816 HIV-1-inficerede voksne med 25 til 250 CD4+ celler pr. mm³ (median = 122 celler pr. mm³) ved baseline blev indskrevet: medianalderen var 36 år, 87% var mænd, 84% var nukleosid-erfarne, og 16% var terapi-naive. Den gennemsnitlige varighed af forsøget var 12 måneder. Resultater er opsummeret i tabel 9.
Surrogat-endepunktsforsøg
Dobbelt nukleosid-analogforsøg
De vigtigste kliniske undersøgelser i den indledende udvikling af lamivudin sammenlignede lamivudin/zidovudin-kombinationer med zidovudin monoterapi eller med zidovudin plus zalcitabin. Disse forsøg viste den antivirale virkning af lamivudin i en kombination af 2 lægemidler. Nyere anvendelser af lamivudin til behandling af HIV-1-infektion inkorporerer det i flere lægemiddelregimer, der indeholder mindst 3 antiretrovirale lægemidler til øget viral suppression.
Sammenligning af dosisregimen Surrogat-endepunktsforsøg hos terapi-naive voksne
EPV20001 var et multicenter, dobbeltblindt, kontrolleret forsøg, hvor forsøgspersoner blev randomiseret 1:1 til at modtage EPIVIR 300 mg én gang dagligt eller EPIVIR 150 mg to gange dagligt i kombination med zidovudin 300 mg to gange dagligt og efavirenz 600 mg én gang dagligt. I alt 554 antiretroviral behandling-naive HIV-1-inficerede voksne inkluderet: mænd (79 %), hvide (50 %), medianalder på 35 år, baseline CD4+ celletal på 69 til 1.089 celler pr. mm³ (median = 362 celler mm³), og median baseline plasma HIV-1 RNA på 4,66 log10 kopier pr. ml. Resultaterne af behandlingen gennem 48 uger er opsummeret i figur 1 og tabel 10.
Figur 1: Virologisk respons til og med uge 48, EPV20001a,b (Intent-to-Treat) 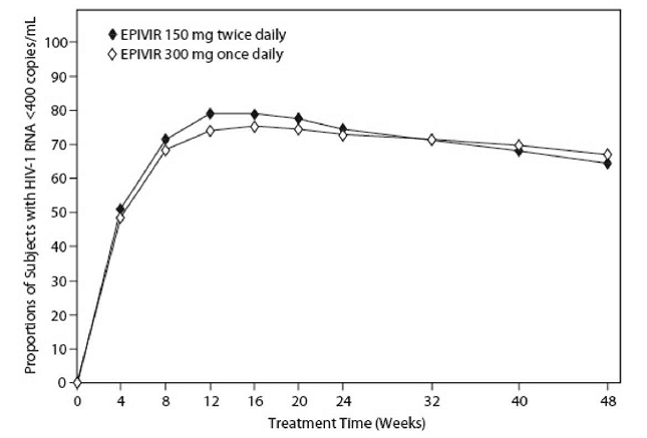
en Roche AMPLICOR HIV-1 MONITOR. b Respondanter ved hvert besøg er forsøgspersoner, som havde opnået og vedligeholdt HIV-1 RNA mindre end 400 kopier pr. ml uden afbrydelse af det besøg.
Andelen af forsøgspersoner med HIV-1 RNA mindre end 50 kopier pr. ml (via Roche Ultrasensitive assay) til og med uge 48 var 61 % for forsøgspersoner, der fik EPIVIR 300 mg én gang dagligt og 63 % for forsøgspersoner, der fik EPIVIR 150 mg to gange dagligt. Median stigning i CD4+-celletal var 144 celler pr. mm³ i uge 48 hos forsøgspersoner, der fik EPIVIR 300 mg én gang dagligt og 146 celler pr. mm3 for forsøgspersoner, der fik EPIVIR 150 mg to gange dagligt.
Et lille, randomiseret, åbent pilotforsøg, EPV40001, blev udført i Thailand. I alt 159 behandlingsnaive voksne forsøgspersoner (mænd 32 %, asiatiske 100 %, medianalder 30 år, baseline median CD4+ celletal 380 celler pr. mm³, median plasma HIV-1 RNA 4,8 log10 kopier pr. ml) blev tilmeldt. To af behandlingsarmene i dette forsøg gav en sammenligning mellem lamivudin 300 mg én gang dagligt (n = 54) og lamivudin 150 mg to gange dagligt (n = 52), hver i kombination med zidovudin 300 mg to gange dagligt og abacavir 300 mg to gange dagligt. I intention-to-treat-analyser af 48-ugers data var andelen af forsøgspersoner med HIV-1 RNA under 400 kopier pr. ml 61 % (33 ud af 54) i gruppen randomiseret til lamivudin én gang dagligt og 75 % (39 af 52) i gruppen randomiseret til at modtage alle 3 lægemidler to gange dagligt; andelene med HIV-1 RNA under 50 kopier pr. ml var 54 % (29 ud af 54) i gruppen med lamivudin én gang dagligt og 67 % (35 af 52) i gruppen med alle to gange dagligt; og den gennemsnitlige stigning i CD4+-celletal var 166 celler pr. mm³ i gruppen med lamivudin én gang dagligt og 216 celler pr. mm³ i gruppen med alle to gange dagligt.
Pædiatriske emner
Klinisk endepunktsforsøg
ACTG300 var et multicenter, randomiseret, dobbeltblindt forsøg, der gjorde det muligt at sammenligne EPIVIR plus RETROVIR (zidovudin) med didanosin monoterapi. I alt 471 symptomatiske, HIV-1-inficerede behandlingsnaive (mindre end eller lig med 56 dages antiretroviral behandling) pædiatriske forsøgspersoner blev inkluderet i disse 2 behandlingsarme. Medianalderen var 2,7 år (interval: 6 uger til 14 år), 58 % var kvinder, og 86 % var ikke-hvide. Det gennemsnitlige CD4+-celletal ved baseline var 868 celler pr. mm³ (gennemsnit: 1.060 celler pr. mm³ og interval: 0 til 4.650 celler pr. mm³ for forsøgspersoner i alderen under eller lig med 5 år; gennemsnit: 419 celler pr. mm³ og interval: 0 til 1.555 celler pr. mm³ for forsøgspersoner over 5 år), og den gennemsnitlige baseline plasma HIV-1 RNA var 5,0 log10 kopier pr. ml. Medianvarigheden i forsøget var 10,1 måneder for forsøgspersonerne, der fik EPIVIR 150 mg plus RETROVIR, og 9,2 måneder for forsøgspersonerne, der fik didanosin-monoterapi. Resultater er opsummeret i tabel 11.
Dosering én gang dagligt
ARROW (COL105677) var et 5-årigt randomiseret multicenterforsøg, som evaluerede flere aspekter af klinisk behandling af HIV-1-infektion hos pædiatriske forsøgspersoner. HIV-1-inficerede, behandlingsnaive forsøgspersoner i alderen 3 måneder til 17 år blev indskrevet og behandlet med en førstelinjebehandling indeholdende EPIVIR 150 mg og abacavir, doseret to gange dagligt i henhold til Verdenssundhedsorganisationens anbefalinger. Efter mindst 36 ugers behandling fik forsøgspersonerne mulighed for at deltage i randomisering 3 af ARROW-studiet, hvor man sammenlignede sikkerheden og effekten af én gang daglig dosering med to gange daglig dosering af EPIVIR og abacavir i kombination med et tredje antiretroviralt middel. medicin i yderligere 96 uger. Af de 1.206 oprindelige ARROW-personer deltog 669 i randomisering 3. Virologisk suppression var ikke et krav for deltagelse: ved baseline for randomisering 3 (efter minimum 36 ugers behandling to gange dagligt), 75 % af forsøgspersonerne i de to gange daglige kohorten var virologisk undertrykt sammenlignet med 71 % af forsøgspersonerne i kohorten én gang dagligt.
Andelen af forsøgspersoner med HIV-1 RNA på mindre end 80 kopier pr. ml gennem 96 uger er vist i tabel 12. Forskellene mellem virologiske responser i de to behandlingsarme var sammenlignelige på tværs af baseline-karakteristika for køn og alder.
Analyser efter formulering viste andelen af forsøgspersoner med HIV-1 RNA på mindre end 80 kopier pr. ml ved randomisering, og uge 96 var højere hos forsøgspersoner, der havde modtaget tabletformuleringer af EPIVIR 150 mg og abacavir (75 % [458/610] og 72 % [434/601]) end hos dem, der havde modtaget opløsningsformulering(er) (med EPIVIR 150 mg opløsning givet i vægtbåndsbaserede doser på ca. 8 mg pr. kg pr. dag) på noget tidspunkt (52 % [29/56] og 54 % [30/56]), henholdsvis [se ADVARSLER OG FORHOLDSREGLER ]. Disse forskelle blev observeret i hver forskellig aldersgruppe, der blev evalueret.
PATIENTOPLYSNINGER
EPIVIR (EP-i-veer) (lamivudin) tabletter
EPIVIR (EP-i-veer) (lamivudin) oral opløsning
Hvad er den vigtigste information, jeg bør vide om EPIVIR 150mg?
EPIVIR kan forårsage alvorlige bivirkninger, herunder:
- Forværring af hepatitis B-virus hos mennesker, der har HIV-1-infektion. Hvis du har HIV-1 (humant immundefektvirus type 1) og hepatitis B-virus (HBV) infektion, kan dit HBV blive værre (opblussen), hvis du holder op med at tage EPIVIR. En "opblussen" er, når din HBV-infektion pludselig vender tilbage på en værre måde end før. Forværret leversygdom kan være alvorlig og kan føre til døden.
- Løb ikke tør for EPIVIR. Genopfyld din recept eller tal med din læge, før din EPIVIR er helt væk.
- Stop ikke EPIVIR uden først at tale med din læge.
- Hvis du holder op med at tage EPIVIR, skal din læge ofte tjekke dit helbred og tage blodprøver regelmæssigt i flere måneder for at kontrollere din lever.
- Resistent hepatitis B-virus (HBV). Hvis du har HIV-1 og hepatitis B, kan hepatitis B-virussen ændre sig (mutere) under din behandling med EPIVIR 150 mg og blive sværere at behandle (resistent).
- Brug sammen med interferon- og ribavirin-baserede regimer. Forværring af leversygdom, der har forårsaget døden, er sket hos personer inficeret med både HIV-1 og hepatitis C-virus, som tager antiretroviral medicin og også behandles for hepatitis C med interferon med eller uden ribavirin. Hvis du tager EPIVIR 150 mg og interferon med eller uden ribavirin, skal du fortælle det til din læge, hvis du har nye symptomer.
Hvad er EPIVIR?
EPIVIR er et receptpligtigt lægemiddel, der bruges sammen med andre antiretrovirale lægemidler til behandling af infektion med humant immundefektvirus (HIV-1).
HIV-1 er den virus, der forårsager Acquired Immune Deficiency Syndrome (AIDS).
EPIVIR-tabletter og oral opløsning (bruges til behandling af HIV-1-infektion) indeholder en højere dosis af det samme aktive stof (lamivudin) end i medicinen EPIVIR-HBV-tabletter og oral opløsning (bruges til behandling af HBV). Hvis du har både HIV-1 og HBV, bør du ikke bruge EPIVIR-HBV til at behandle dine infektioner.
Sikkerheden og effektiviteten af EPIVIR er ikke blevet fastslået hos børn under 3 måneder.
Hvem bør ikke tage EPIVIR 150mg?
Tag ikke EPIVIR hvis du er allergisk over for lamivudin eller et af indholdsstofferne i EPIVIR. Se slutningen af denne indlægsseddel for en komplet liste over ingredienser i EPIVIR.
Hvad skal jeg fortælle min sundhedsplejerske, før jeg tager EPIVIR?
Inden du tager EPIVIR 150mg, skal du fortælle det til din læge, hvis du:
- har eller har haft leverproblemer, herunder hepatitis B- eller C-virusinfektion.
- har nyreproblemer.
- har diabetes. Hver dosis på 15 ml (150 mg) EPIVIR oral opløsning indeholder 3 gram saccharose.
- er gravid eller planlægger at blive gravid. Indtagelse af EPIVIR under graviditet har ikke været forbundet med en øget risiko for fødselsdefekter. Tal med din læge, hvis du er gravid eller planlægger at blive gravid. Graviditetsregister. Der findes et graviditetsregister for kvinder, der tager antiretroviral medicin under graviditeten. Formålet med dette register er at indsamle oplysninger om helbredet for dig og din baby. Tal med din sundhedsudbyder om, hvordan du kan deltage i dette register.
- ammer eller planlægger at amme. Du må ikke amme, hvis du tager EPIVIR.
- Du bør ikke amme, hvis du har HIV-1 på grund af risikoen for at overføre HIV-1 til din baby.
Fortæl din læge om al den medicin, du tager, herunder receptpligtig og håndkøbsmedicin, vitaminer og naturlægemidler.
Nogle lægemidler interagerer med EPIVIR. Hold en liste over dine lægemidler og vis den til din læge og apotek, når du får en ny medicin. Du kan bede din sundhedsudbyder eller apoteket om en liste over lægemidler, der interagerer med EPIVIR.
Begynd ikke at tage en ny medicin uden at fortælle det til din læge. Din læge kan fortælle dig, om det er sikkert at tage EPIVIR sammen med anden medicin.
Hvordan skal jeg tage EPIVIR?
- Tag EPIVIR nøjagtigt som din læge fortæller dig at tage det.
- Hvis du glemmer en dosis af EPIVIR 150 mg, skal du tage den, så snart du husker det. Du må ikke tage 2 doser på samme tid eller tage mere, end hvad din læge fortæller dig at tage.
- Bliv under behandling af en sundhedsplejerske under behandling med EPIVIR.
- EPIVIR kan tages med eller uden mad.
- Til børn på 3 måneder og ældre vil din læge ordinere en dosis EPIVIR 150 mg baseret på dit barns kropsvægt.
- Fortæl det til din læge, hvis du eller dit barn har problemer med at sluge tabletter. EPIVIR 150mg kommer også som en væske (oral opløsning).
- Løb ikke tør for EPIVIR. Virussen i dit blod kan øges, og virussen kan blive sværere at behandle. Når din forsyning begynder at løbe tør, få mere fra din sundhedsudbyder eller apotek.
- Hvis du tager for meget EPIVIR 150 mg, skal du ringe til din læge eller gå til den nærmeste skadestue.
Hvad er de mulige bivirkninger af EPIVIR 150mg?
- EPIVIR 150mg kan forårsage alvorlige bivirkninger, herunder:
- Se "Hvad er den vigtigste information, jeg bør vide om EPIVIR 150mg?"
- Opbygning af en syre i dit blod (laktatacidose). Laktatacidose kan forekomme hos nogle mennesker, der tager EPIVIR. Laktacidose er en alvorlig medicinsk nødsituation, der kan forårsage død. Ring til din læge med det samme, hvis du får nogle af følgende symptomer, der kan være tegn på laktatacidose:
- føler sig meget svag eller træt
- føler dig kold, især i dine arme og ben
- usædvanlige (ikke normale) muskelsmerter
- føler sig svimmel eller svimmel
- vejrtrækningsbesvær
- har en hurtig eller uregelmæssig hjerterytme
- mavesmerter med kvalme og opkastning
- Alvorlige leverproblemer kan forekomme hos personer, der tager EPIVIR. I nogle tilfælde kan disse alvorlige leverproblemer føre til døden. Din lever kan blive stor (hepatomegali), og du kan udvikle fedt i leveren (steatose). Ring med det samme til din læge, hvis du får nogle af følgende tegn eller symptomer på leverproblemer:
- din hud eller den hvide del af dine øjne bliver gul (gulsot)
- tab af appetit i flere dage eller længere
- kvalme
- mørk eller "te-farvet" urin
- smerte, ømhed eller ømhed i højre side af dit maveområde
- lys afføring (afføring)
Du kan være mere tilbøjelig til at få laktatacidose eller alvorlige leverproblemer, hvis du er kvinde eller meget overvægtig (fede).
- Risiko for betændelse i bugspytkirtlen (pancreatitis). Børn kan være i risiko for at udvikle pancreatitis under behandling med EPIVIR, hvis de:
- har taget nukleosidanalog medicin
- har en historie med pancreatitis i fortiden
- har andre risikofaktorer for pancreatitis
Ring til din læge med det samme, hvis dit barn udvikler tegn og symptomer på bugspytkirtelbetændelse, herunder svære smerter i det øvre maveområde, med eller uden kvalme og opkastning. Din læge kan bede dig om at stoppe med at give EPIVIR 150 mg til dit barn, hvis deres symptomer og blodprøveresultater viser, at dit barn kan have pancreatitis.
- Ændringer i dit immunsystem (Immun Reconstitution Syndrome) kan ske, når du begynder at tage HIV-1-medicin. Dit immunsystem kan blive stærkere og begynde at bekæmpe infektioner, der har været skjult i din krop i lang tid. Fortæl din læge med det samme, hvis du begynder at få nye symptomer, efter du er begyndt at tage EPIVIR.
De mest almindelige bivirkninger af EPIVIR 150mg hos voksne omfatter:
- hovedpine
- nasale tegn og symptomer
- kvalme
- diarré
- generelt ikke har det godt
- træthed
- hoste
De mest almindelige bivirkninger af EPIVIR 150 mg hos børn omfatter feber og hoste.
Fortæl din læge, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af EPIVIR. Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg opbevare EPIVIR?
- Opbevar EPIVIR 150 mg tabletter og oral opløsning ved stuetemperatur mellem 68°F til 77°F (20°C til 25°C).
- Hold flasker med EPIVIR 150 mg oral opløsning tæt lukket.
Opbevar EPIVIR og al medicin utilgængeligt for børn.
Generel information om sikker og effektiv brug af EPIVIR.
Lægemidler ordineres nogle gange til andre formål end dem, der er anført i en patientinformationsfolder. Brug ikke EPIVIR til en tilstand, som det ikke er ordineret til. Giv ikke EPIVIR til andre mennesker, selvom de har de samme symptomer, som du har. Det kan skade dem.
Du kan bede din sundhedsplejerske eller apotek om oplysninger om EPIVIR 150mg, der er skrevet til sundhedspersonale.
For mere information, gå til www.viivhealthcare.com eller ring på 1-877-844-8872.
Hvad er ingredienserne i EPIVIR 150mg?
Aktiv ingrediens: lamivudin
Inaktive ingredienser:
EPIVIR 150mg 150 mg filmovertrukne tabletter med delekærv: hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, natriumstivelsesglykolat og titaniumdioxid.
EPIVIR 300 mg filmovertrukne tabletter: sort jernoxid, hypromellose, magnesiumstearat, mikrokrystallinsk cellulose, polyethylenglycol, polysorbat 80, natriumstivelsesglykolat og titaniumdioxid.
EPIVIR 150 mg oral opløsning: kunstige jordbær- og bananaromaer, citronsyre (vandfri), methylparaben, propylenglycol, propylparaben, natriumcitrat (dihydrat) og saccharose (200 mg pr. ml).
Denne patientinformation er blevet godkendt af US Food and Drug Administration.
