Xalatan 2.5ml Latanoprost Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
XALATAN® (latanoprost) Oftalmisk opløsning
BESKRIVELSE
Latanoprost er en prostaglandin F2α-analog. Dets kemiske navn er isopropyl-(Z)-7[(1R,2R,3R,5S)3,5dihydroxy-2-[(3R)-3-hydroxy-5-phenylpentyl]cyclopentyl]-5-heptenoat. Dens molekylære formel er C26H40O5 og dens kemiske struktur er:
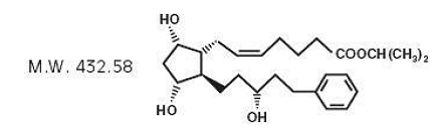
Latanoprost er en farveløs til svagt gul olie, der er meget opløselig i acetonitril og frit opløselig i acetone, ethanol, ethylacetat, isopropanol, methanol og octanol. Det er praktisk talt uopløseligt i vand.
XALATAN (latanoprost oftalmisk opløsning) 0,005% leveres som en steril, isotonisk, bufret vandig opløsning af latanoprost med en pH på ca. 6,7 og en osmolalitet på ca. 267 mOsmol/kg. Hver ml XALATAN indeholder 50 mcg latanoprost. Benzalkoniumchlorid, 0,02% tilsættes som konserveringsmiddel. De inaktive ingredienser er: natriumchlorid, natriumdihydrogenphosphatmonohydrat, dinatriumhydrogenphosphat vandfri og vand til injektion. En dråbe indeholder cirka 1,5 mcg latanoprost.
INDIKATIONER
XALATAN 2,5 ml er indiceret til reduktion af forhøjet intraokulært tryk hos patienter med åbenvinklet glaukom eller okulær hypertension.
DOSERING OG ADMINISTRATION
Den anbefalede dosis er én dråbe i det eller de berørte øjne én gang dagligt om aftenen. Hvis en dosis glemmes, skal behandlingen fortsætte med den næste dosis som normalt.
Dosis af XALATAN bør ikke overstige én gang dagligt; kombineret brug af to eller flere prostaglandiner eller prostaglandinanaloger inklusive XALATAN 2,5 ml anbefales ikke. Det er vist, at administration af disse prostaglandinlægemidler mere end én gang dagligt kan reducere den intraokulære tryksænkende effekt eller forårsage paradoksale stigninger i IOP.
Reduktion af IOP starter cirka 3 til 4 timer efter administration, og den maksimale effekt nås efter 8 til 12 timer.
XALATAN kan anvendes samtidig med andre topiske oftalmiske lægemidler for at sænke IOP. Hvis der anvendes mere end ét topisk oftalmisk lægemiddel, skal lægemidlet indgives med mindst fem (5) minutters mellemrum. Kontaktlinser skal fjernes før administration af XALATAN 2,5 ml og kan genindsættes 15 minutter efter administration
HVORDAN LEVERET
Doseringsformer og styrker
Steril oftalmisk opløsning indeholdende 50 mcg/ml latanoprost.
Opbevaring og håndtering
XALATAN er en klar, isotonisk, bufret, konserveret farveløs opløsning af latanoprost 0,005 % (50 mcg/ml). Det leveres som en 2,5 mL opløsning i en 5 mL klar lavdensitets polyethylenflaske med en klar polyethylen dråbespids, et turkis højdensitet polyethylen skruelåg og en manipulationssikker, klar lavdensitet polyethylen låg.
2,5 mL fyld, 0,005 % (50 mcg/ml): Pakke med 1 flaske: NDC 0013-8303-04 2,5 ml fyld, 0,005 % (50 mcg/ml): Multipakning med 3 flasker: NDC 0013-8303-01
Opbevaring
Beskyt mod lys. Opbevar uåbnede flaske(r) i køleskab ved 2° til 8°C (36° til 46°F). Under forsendelse til patienten kan flasken holdes ved temperaturer op til 40°C (104°F) i en periode på højst 8 dage. Når en flaske er åbnet til brug, kan den opbevares ved stuetemperatur op til 25°C (77°F) i 6 uger.
Distribueret af: Pharmacia & Upjohn Co., Division of Pfizer Inc., NY, NY 10017. Pfizer Manufacturing Belgium NV Puurs, Belgien. Revideret: n/a
BIVIRKNINGER
Følgende bivirkninger blev rapporteret efter markedsføring og er diskuteret mere detaljeret i andre afsnit af etiketten:
- Irispigmenteringsændringer [se ADVARSLER OG FORHOLDSREGLER ]
- Øjenlågshud mørkere [se ADVARSLER OG FORHOLDSREGLER ]
- Ændringer i øjenvipper (øget længde, tykkelse, pigmentering og antal vipper) [se ADVARSLER OG FORHOLDSREGLER ]
- Intraokulær betændelse (iritis/uveitis) [se ADVARSLER OG FORHOLDSREGLER ]
- Makulaødem, herunder cystoid makulaødem [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan de bivirkninger, der er observeret i de kliniske undersøgelser af et lægemiddel, ikke direkte sammenlignes med frekvenserne i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der er observeret i klinisk praksis.
XALATAN 2,5 ml blev undersøgt i tre multicenter, randomiserede, kontrollerede kliniske forsøg. Patienterne fik 50 mcg/ml XALATAN én gang dagligt eller 5 mg/ml aktivt komparator (timolol) to gange dagligt. Den undersøgte patientpopulation havde en gennemsnitsalder på 65±10 år. Syv procent af patienterne trak sig tilbage før 6-måneders endepunktet.
Mindre end 1 % af patienterne behandlet med XALATAN 2,5 ml krævede seponering af behandlingen på grund af intolerance over for konjunktival hyperæmi.
Den okulære hændelse/tegn og symptomer på blepharitis er blevet identificeret som "almindeligt observeret" gennem analyse af data fra kliniske forsøg.
Postmarketing oplevelse
Følgende reaktioner er blevet identificeret under postmarketing brug af XALATAN i klinisk praksis. Fordi de rapporteres frivilligt fra en population af ukendt størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Reaktionerne, som er valgt til inklusion på grund af enten deres alvor, hyppighed af rapportering, mulige årsagssammenhænge til XALATAN 2,5 ml eller en kombination af disse faktorer, omfatter:
Forstyrrelser i nervesystemet: Svimmelhed; hovedpine; toksisk epidermal nekrolyse
Øjenlidelser: Øjenvipper og vellushår ændringer i øjenlåget (øget længde, tykkelse, pigmentering og antal øjenvipper); keratitis; hornhindeødem og erosioner; intraokulær betændelse (iritis/uveitis); makulaødem, herunder cystoid makulaødem; trichiasis; periorbitale og lågændringer, der resulterer i uddybning af øjenlågssulcus; iris cyste; mørkere øjenlågshud; lokaliseret hudreaktion på øjenlågene; konjunktivitis; pseudopemfigoid i øjets bindehinde
Åndedræts-, thorax- og mediastinale lidelser: Astma og forværring af astma; dyspnø
Hud- og subkutane vævsforstyrrelser: Kløe
Infektioner og angreb: Herpes keratitis
Hjertelidelser: Angina; hjertebanken; angina ustabil
Generelle lidelser og administrationsbetingelser: Brystsmerter
DRUGSINTERAKTIONER
In vitro undersøgelser har vist, at udfældning opstår, når øjendråber indeholdende thimerosal blandes med XALATAN. Hvis sådanne lægemidler anvendes, bør de indgives med mindst fem (5) minutters mellemrum.
Kombineret brug af to eller flere prostaglandiner eller prostaglandinanaloger inklusive XALATAN 2,5 ml anbefales ikke. Det er blevet vist, at administration af disse prostaglandinlægemidler mere end én gang dagligt kan mindske den IOP-sænkende effekt eller forårsage paradoksale stigninger i IOP.
ADVARSLER
Inkluderet som en del af FORHOLDSREGLER afsnit.
FORHOLDSREGLER
Pigmentering
XALATAN er blevet rapporteret at forårsage ændringer i pigmenteret væv. De hyppigst rapporterede ændringer har været øget pigmentering af iris, periorbitalt væv (øjenlåg) og øjenvipper. Pigmenteringen forventes at stige, så længe latanoprost administreres.
Pigmenteringsændringen skyldes øget melaninindhold i melanocytterne snarere end en stigning i antallet af melanocytter. Efter seponering af latanoprost er pigmentering af iris sandsynligvis permanent, mens pigmentering af det periorbitale væv og øjenvippeforandringer er blevet rapporteret at være reversibel hos nogle patienter. Patienter, der modtager behandling, bør informeres om muligheden for øget pigmentering. Efter 5 år kendes virkningerne af øget pigmentering ikke [se Kliniske Studier ].
Irisfarveændring er muligvis ikke mærkbar i flere måneder til år. Typisk spredes den brune pigmentering omkring pupillen koncentrisk mod regnbuehindens periferi og hele regnbuehinden eller dele af regnbuen bliver mere brunlig. Hverken nevi eller irisfregner ser ud til at være påvirket af behandlingen. Mens behandling med XALATAN 2,5 ml kan fortsættes hos patienter, som udvikler mærkbart øget irispigmentering, bør disse patienter undersøges regelmæssigt [se PATIENTOPLYSNINGER ].
Ændringer i øjenvipper
XALATAN 2,5 ml kan gradvist ændre øjenvipper og vellushår i det behandlede øje; disse ændringer omfatter øget længde, tykkelse, pigmentering, antallet af vipper eller hår og forkert vækst af øjenvipper. Øjenvippeforandringer er normalt reversible ved seponering af behandlingen [se PATIENTOPLYSNINGER ].
Intraokulær betændelse
XALATAN 2,5 ml bør anvendes med forsigtighed til patienter med en anamnese med intraokulær inflammation (iritis/uveitis) og bør generelt ikke anvendes til patienter med aktiv intraokulær inflammation, da inflammation kan blive forværret.
Makulaødem
Makulaødem, inklusive cystoid makulaødem, er blevet rapporteret under behandling med XALATAN. XALATAN 2,5 ml bør anvendes med forsigtighed til afake patienter, til pseudofake patienter med en revet bagerste linsekapsel eller til patienter med kendte risikofaktorer for makulaødem.
Herpetisk keratitis
Reaktivering af Herpes Simplex keratitis er blevet rapporteret under behandling med XALATAN. XALATAN 2,5 ml bør anvendes med forsigtighed til patienter med en historie med herpetisk keratitis. XALATAN 2,5 ml bør undgås i tilfælde af aktiv herpes simplex keratitis, fordi inflammation kan forværres.
Bakteriel keratitis
Der har været rapporter om bakteriel keratitis forbundet med brugen af flerdosisbeholdere med topiske oftalmiske produkter. Disse beholdere var utilsigtet blevet kontamineret af patienter, der i de fleste tilfælde havde en samtidig hornhindesygdom eller en forstyrrelse af den okulære epiteloverflade [se PATIENTOPLYSNINGER ].
Brug med kontaktlinser
Kontaktlinser skal fjernes før administration af XALATAN og kan genindsættes 15 minutter efter administration.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Latanoprost var ikke kræftfremkaldende hos hverken mus eller rotter, når det blev indgivet ved oral sonde i doser på op til 170 mcg/kg/dag (ca. 2800 gange den anbefalede maksimale humane dosis) i henholdsvis op til 20 og 24 måneder.
Latanoprost var ikke mutagent i bakterier, i muselymfom eller i mikronukleustest hos mus. Kromosomafvigelser blev observeret in vitro med humane lymfocytter. Yderligere in vitro og in vivo undersøgelser af ikke-planlagt DNA-syntese hos rotter var negative.
Latanoprost har ikke vist sig at have nogen effekt på mandlig eller kvindelig fertilitet i dyreforsøg.
Brug i specifikke populationer
Graviditet
Teratogene virkninger
Graviditetskategori C.
Reproduktionsundersøgelser er blevet udført på rotter og kaniner. Hos kaniner havde en forekomst på 4 ud af 16 moderdyr ingen levedygtige fostre ved en dosis, der var ca. 80 gange den maksimale humane dosis, og den højeste ikke-embryocidale dosis hos kaniner var ca. 15 gange den maksimale humane dosis.
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af gravide kvinder. XALATAN 2,5 ml bør kun anvendes under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Ammende mødre
Det vides ikke, om dette lægemiddel eller dets metabolitter udskilles i modermælk. Da mange lægemidler udskilles i modermælk, bør der udvises forsigtighed, når XALATAN 2,5 ml administreres til en ammende kvinde.
Pædiatrisk brug
Sikkerhed og effektivitet hos pædiatriske patienter er ikke blevet fastslået.
Geriatrisk brug
Der er ikke observeret nogen overordnede forskelle i sikkerhed eller effektivitet mellem ældre og yngre patienter.
OVERDOSIS
Intravenøs infusion på op til 3 mcg/kg hos raske frivillige gav gennemsnitlige plasmakoncentrationer 200 gange højere end under klinisk behandling, og der blev ikke observeret nogen bivirkninger. Intravenøse doser på 5,5 til 10 mcg/kg forårsagede mavesmerter, svimmelhed, træthed, hedeture, kvalme og svedtendens. Hvis overdosering med XALATAN forekommer, bør behandlingen være symptomatisk.
KONTRAINDIKATIONER
Kendt overfølsomhed over for latanoprost, benzalkoniumchlorid eller andre ingredienser i dette produkt.
KLINISK FARMAKOLOGI
Handlingsmekanisme
Latanoprost er en prostanoid-selektiv FP-receptoragonist, der menes at reducere det intraokulære tryk (IOP) ved at øge udstrømningen af kammervand. Undersøgelser i dyr og mennesker tyder på, at den vigtigste virkningsmekanisme er øget uveoskleral udstrømning. Forhøjet IOP repræsenterer en væsentlig risikofaktor for glaukom-felttab. Jo højere niveau af IOP, jo større er sandsynligheden for skade på synsnerven og tab af synsfelt.
Farmakodynamik
Reduktion af IOP hos mennesker starter ca. 3-4 timer efter administration og maksimal effekt nås efter 8-12 timer. IOP-reduktion er til stede i mindst 24 timer.
Farmakokinetik
Absorption
Latanoprost absorberes gennem hornhinden, hvor isopropylesterprodruget hydrolyseres til syreformen for at blive biologisk aktivt.
Fordeling
Fordelingsvolumen hos mennesker er 0,16 ± 0,02 l/kg. Syren af latanoprost kan måles i kammervand i løbet af de første 4 timer og kun i plasma i den første time efter lokal administration. Undersøgelser hos mennesker indikerer, at den maksimale koncentration i kammervandet nås ca. to timer efter topisk administration.
Metabolisme
Latanoprost, et isopropylester-prodrug, hydrolyseres af esteraser i hornhinden til den biologisk aktive syre. Den aktive syre af latanoprost, der når det systemiske kredsløb, metaboliseres primært af leveren til 1,2-dinor- og 1,2,3,4-tetranor-metabolitterne via fedtsyre-β-oxidation.
Udskillelse
Elimineringen af syren i latanoprost fra humant plasma er hurtig (t½ = 17 min) efter både intravenøs og topisk administration. Systemisk clearance er ca. 7 ml/min/kg. Efter hepatisk β-oxidation elimineres metabolitterne hovedsageligt via nyrerne. Ca. 88 % og 98 % af den administrerede dosis genfindes i urinen efter henholdsvis topisk og intravenøs dosering.
Kliniske Studier
Forhøjet basislinje IOP
Patienter med gennemsnitlig baseline IOP på 24 - 25 mmHg, som blev behandlet i 6 måneder i multicenter, randomiserede, kontrollerede undersøgelser viste 6 - 8 mmHg reduktioner i IOP. Denne IOP-reduktion med XALATAN 0,005% doseret én gang dagligt svarede til virkningen af timolol 0,5% doseret to gange dagligt.
Progression af øget irispigmentering
Et 3-årigt åbent, prospektivt sikkerhedsstudie med en 2-årig forlængelsesfase blev udført for at evaluere progressionen af øget irispigmentering med kontinuerlig brug af XALATAN én gang dagligt som supplerende behandling hos 519 patienter med åbenvinklet glaukom. Analysen var baseret på observerede tilfældes population af de 380 patienter, som fortsatte i forlængelsesfasen.
Resultaterne viste, at indtræden af mærkbar øget irispigmentering forekom inden for det første behandlingsår for størstedelen af de patienter, som udviklede mærkbar øget irispigmentering. Patienterne fortsatte med at vise tegn på stigende irispigmentering gennem de fem år, undersøgelsen varede. Observation af øget irispigmentering påvirkede ikke forekomsten, arten eller sværhedsgraden af bivirkninger (bortset fra øget irispigmentering) registreret i undersøgelsen. IOP-reduktionen var ens, uanset udviklingen af øget irispigmentering under undersøgelsen.
PATIENTOPLYSNINGER
Potentiale for pigmentering
Rådgiv patienterne om potentialet for øget brun pigmentering af iris, som kan være permanent. Informer patienterne om muligheden for, at øjenlågshuden bliver mørkere, hvilket kan være reversibelt efter seponering af XALATAN [se ADVARSLER OG FORHOLDSREGLER ].
Potentiale for øjenvippeforandringer
Informer patienterne om muligheden for ændringer i øjenvipper og vellushår i det behandlede øje under behandling med XALATAN. Disse ændringer kan resultere i en forskel mellem øjnene i længde, tykkelse, pigmentering, antal øjenvipper eller vellushår og/eller øjenvippernes vækstretning. Øjenvippeforandringer er normalt reversible ved seponering af behandlingen.
Håndtering af containeren
Instruer patienterne i at undgå at lade spidsen af dispenseringsbeholderen komme i kontakt med øjet eller omgivende strukturer, da dette kan forårsage, at spidsen bliver kontamineret af almindelige bakterier, der vides at forårsage øjeninfektioner. Alvorlig skade på øjet og efterfølgende tab af synet kan skyldes brug af kontaminerede opløsninger [se ADVARSLER OG FORHOLDSREGLER ].
Hvornår skal man søge lægeråd
Rådgiv patienter om, at hvis de udvikler en interkurrent øjenlidelse (f.eks. traumer eller infektion) eller får øjenkirurgi eller udvikler øjenreaktioner, især konjunktivitis og øjenlågsreaktioner, skal de straks søge deres læges råd angående fortsat brug af multiple-dosis beholder.
Brug med kontaktlinser
Rådfør patienterne om, at XALATAN 2,5 ml indeholder benzalkoniumchlorid, som kan absorberes af kontaktlinser. Kontaktlinser skal fjernes før administration af opløsningen. Linser kan genindsættes 15 minutter efter administration af XALATAN.
Brug sammen med andre oftalmologiske lægemidler
Hvis der anvendes mere end ét topisk oftalmisk lægemiddel, skal lægemidlet indgives med mindst fem (5) minutters mellemrum.
