Øjendråber: Lumigan 3ml Anvendelse, bivirkninger og dosering. Pris i onlineapotek. Generisk medicin uden recept.
Hvad er Lumigan, og hvordan bruges det?
Lumigan 3ml er en receptpligtig medicin, der bruges til at behandle symptomerne på forhøjet intraokulært tryk forårsaget af visse typer glaukom og hypotrikose af øjenvipper. Lumigan kan bruges alene eller sammen med anden medicin.
Lumigan tilhører en klasse af lægemidler kaldet antiglaukom, prostaglandinagonister.
Det vides ikke, om Lumigan er sikkert og effektivt til børn.
Hvad er de mulige bivirkninger af Lumigan?
Lumigan kan forårsage alvorlige bivirkninger, herunder:
- hævelse af øjnene,
- rødme i øjet,
- alvorligt ubehag i øjet,
- skorpedannelse eller dræning fra øjet,
- synsforandringer, og
- røde, hævede eller kløende øjenlåg
Få lægehjælp med det samme, hvis du har nogle af symptomerne nævnt ovenfor.
De mest almindelige bivirkninger af Lumigan omfatter:
- rødme i øjnene
Fortæl det til lægen, hvis du har en bivirkning, der generer dig, eller som ikke forsvinder.
Disse er ikke alle de mulige bivirkninger af Lumigan. Spørg din læge eller apotek for mere information.
Ring til din læge for lægehjælp om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
LUMIGAN® (bimatoprost oftalmisk opløsning) 0,03% er en syntetisk prostamidanalog med okulær hypotensiv aktivitet. Dets kemiske navn er (Z)-7-[(1R,2R,3R,5S)-3,5-Dihydroxy-2[(1E,3S)-3-hydroxy-5-phenyl-1-pentenyl]cyclopentyl]- 5-N-ethylheptenamid, og dets molekylvægt er 415,58. Dens molekylære formel er C25H37NO4. Dens kemiske struktur er:
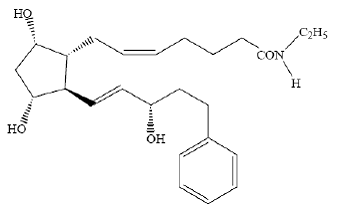
Bimatoprost er et pulver, som er meget opløseligt i ethylalkohol og methylalkohol og let opløseligt i vand. LUMIGAN® 0,03% er en klar, isotonisk, farveløs, steril oftalmisk opløsning med en osmolalitet på ca. 290 mOsmol/kg.
LUMIGAN® 0,03% indeholder Aktiv: bimatoprost 0,3 mg/ml; Inaktive: benzalkoniumchlorid 0,05 mg/ml; natriumchlorid; natriumphosphat, dibasisk; Citronsyre; og renset vand. Natriumhydroxid og/eller saltsyre kan tilsættes for at justere pH. pH i dets holdbarhed varierer fra 6,8-7,8.
INDIKATIONER
LUMIGAN® (bimatoprost oftalmisk opløsning) 0,01 % er indiceret til reduktion af forhøjet intraokulært tryk hos patienter med åbenvinklet glaukom eller okulær hypertension.
DOSERING OG ADMINISTRATION
Den anbefalede dosis er én dråbe i det eller de berørte øjne én gang dagligt om aftenen. LUMIGAN® (bimatoprost oftalmisk opløsning) 0,01 % bør ikke administreres mere end én gang dagligt, da det har vist sig, at hyppigere administration af prostaglandinanaloger kan nedsætte den intraokulære tryksænkende effekt.
Reduktion af det intraokulære tryk starter cirka 4 timer efter den første administration med maksimal effekt nået inden for cirka 8 til 12 timer.
LUMIGAN® 0,01% kan anvendes samtidig med andre topiske oftalmiske lægemidler for at sænke det intraokulære tryk. Hvis der anvendes mere end ét topisk oftalmisk lægemiddel, skal lægemidlet indgives med mindst fem (5) minutters mellemrum.
HVORDAN LEVERET
Doseringsformer og styrker
Oftalmisk opløsning indeholdende bimatoprost 0,1 mg/ml.
Opbevaring og Håndtering
LUMIGAN® (bimatoprost oftalmisk opløsning) 0,01 % leveres sterilt i uigennemsigtige hvide lavdensitets polyethylen oftalmiske dispenserflasker og spidser med turkis polystyren låg i følgende størrelser:
2,5 mL fyld i en 5 mL beholder - NDC 0023-3205-03 5 mL fyld i en 10 mL beholder - NDC 0023-3205-05 7,5 mL fyld i en 10 mL beholder - NDC 0023-3205-08
Opbevaring: Opbevares ved 2°C til 25°C (36°F til 77°F).
Efter åbning kan LUMIGAN® 0,01% bruges indtil udløbsdatoen på flasken.
Distribueret af: Allergan USA, Inc. Madison, NJ 07940. Revideret: Mar 2022
BIVIRKNINGER
Følgende bivirkninger er beskrevet andetsteds i mærkningen:
- Pigmentering inklusive blepharal pigmentering og iris hyperpigmentering [se ADVARSLER OG FORHOLDSREGLER ]
- Øjenvippeforandringer [se ADVARSLER OG FORHOLDSREGLER ]
- Intraokulær betændelse [se ADVARSLER OG FORHOLDSREGLER ]
- Makulaødem [se ADVARSLER OG FORHOLDSREGLER ]
- Overfølsomhed [se KONTRAINDIKATIONER ]
Erfaring med kliniske forsøg
Fordi kliniske forsøg udføres under vidt forskellige forhold, kan bivirkningsrater observeret i de kliniske forsøg med et lægemiddel ikke direkte sammenlignes med hastigheder i de kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de frekvenser, der observeres i praksis.
et 12-måneders klinisk studie med bimatoprost oftalmiske opløsninger 0,01 % var den mest almindelige bivirkning konjunktival hyperæmi (31 %). Ca. 1,6 % af patienterne afbrød behandlingen på grund af konjunktival hyperæmi. Andre bivirkninger (rapporteret hos 1 til 4 % af patienterne) med LUMIGAN® 0,01 % i denne undersøgelse inkluderede konjunktival ødem, conjunctival blødning, øjenirritation, øjensmerter, øjenkløe, erytem i øjenlåget, øjenlågskløe, vækst af øjenvipper, hypertrichose, irritation af instillationsstedet, punktat keratitis, hudhyperpigmentering og synslørhed, reduceret.
Postmarketing oplevelse
Følgende bivirkninger er blevet identificeret under brug efter godkendelse af LUMIGAN® 0,01 %. Fordi disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt pålideligt at estimere deres hyppighed eller etablere en årsagssammenhæng til lægemiddeleksponering. Disse reaktioner, som er valgt til medtagelse enten på grund af deres alvor, hyppighed af rapportering, mulige årsagssammenhænge til LUMIGAN® , eller en kombination af disse faktorer omfatter: astma-lignende symptomer, svimmelhed, tørre øjne, dyspnø, øjenudflåd, øjenødem, fornemmelse af fremmedlegemer, hovedpine, overfølsomhed inklusive tegn og symptomer på øjenallergi og allergisk dermatitis, hypertension, øget tåredannelse, periorbitale og lågforandringer, herunder uddybning af øjenlågssulcus, og fotofobi.
DRUGSINTERAKTIONER
Ingen oplysninger givet
ADVARSLER
Inkluderet som en del af "FORHOLDSREGLER" Afsnit
FORHOLDSREGLER
Pigmentering
Bimatoprost oftalmisk opløsning er blevet rapporteret at forårsage ændringer i pigmenteret væv. De hyppigst rapporterede ændringer har været øget pigmentering af iris, periorbitalt væv (øjenlåg) og øjenvipper. Pigmenteringen forventes at stige, så længe bimatoprost administreres. Pigmenteringsændringen skyldes øget melaninindhold i melanocytterne snarere end en stigning i antallet af melanocytter. Efter seponering af bimatoprost er pigmentering af iris sandsynligvis permanent, mens pigmentering af det periorbitale væv og øjenvippeforandringer er blevet rapporteret at være reversibel hos nogle patienter. Patienter, der modtager behandling, bør informeres om muligheden for øget pigmentering. De langsigtede virkninger af øget pigmentering kendes ikke.
Irisfarveændring er muligvis ikke mærkbar i flere måneder til år. Typisk spredes den brune pigmentering omkring pupillen koncentrisk mod regnbuehindens periferi og hele regnbuehinden eller dele af regnbuen bliver mere brunlig. Hverken nevi eller irisfregner ser ud til at være påvirket af behandlingen. Mens behandling med LUMIGAN® (bimatoprost oftalmisk opløsning) 0,01 % kan fortsættes hos patienter, som udvikler mærkbart øget irispigmentering, bør disse patienter undersøges regelmæssigt.
Ændringer i øjenvipper
LUMIGAN® 0,01% kan gradvist ændre øjenvipper og vellushår i det behandlede øje. Disse ændringer omfatter øget længde, tykkelse og antallet af vipper. Øjenvippeforandringer er normalt reversible ved seponering af behandlingen.
Intraokulær betændelse
Prostaglandinanaloger, herunder bimatoprost, er blevet rapporteret at forårsage intraokulær inflammation. Da disse produkter kan forværre inflammation, bør der udvises forsigtighed hos patienter med aktiv intraokulær inflammation (f.eks. uveitis).
Makulaødem
Makulaødem, inklusive cystoid makulaødem, er blevet rapporteret under behandling med bimatoprost oftalmisk opløsning. LUMIGAN® 0,01% bør anvendes med forsigtighed til afake patienter, til pseudofake patienter med en revet bagerste linsekapsel eller til patienter med kendte risikofaktorer for makulaødem.
Bakteriel keratitis
Der har været rapporter om bakteriel keratitis forbundet med brugen af flerdosisbeholdere med topiske oftalmiske produkter. Disse beholdere var utilsigtet blevet kontamineret af patienter, som i de fleste tilfælde havde en samtidig hornhindesygdom eller en forstyrrelse af den okulære epiteloverflade.
Brug af kontaktlinser
LUMIGAN® 0,01% indeholder benzalkoniumchlorid, som kan absorberes af og forårsage misfarvning af bløde kontaktlinser. Kontaktlinser skal fjernes før instillation af LUMIGAN® 0,01% og kan genindsættes 15 minutter efter indgivelsen.
Ikke-klinisk toksikologi
Karcinogenese, mutagenese, svækkelse af fertilitet
Karcinogenese
Bimatoprost var ikke kræftfremkaldende hos hverken mus eller rotter, når det blev indgivet ved oral sonde i 104 uger i doser op til henholdsvis 2 mg/kg/dag og 1 mg/kg/dag (192 og 291 gange den estimerede humane systemiske eksponering for bimatoprost 0,03 % doseres bilateralt henholdsvis én gang dagligt baseret på blodets AUC-niveauer)
Mutagenese
Bimatoprost var ikke mutagen eller klastogen i Ames-testen, i muse-lymfomtesten eller i in vivo-mus mikronucleus-testene.
Forringelse af fertilitet
Bimatoprost forringede ikke fertiliteten hos han- eller hunrotter op til doser på 0,6 mg/kg/dag (mindst 103 gange den anbefalede humane eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt baseret på blodets AUC-niveauer).
Brug i specifikke populationer
Graviditet
Risikooversigt
Der er ingen tilstrækkelige og velkontrollerede undersøgelser af LUMIGAN® (bimatoprost oftalmisk opløsning) 0,01 % administration til gravide kvinder. Der er ingen stigning i risikoen for alvorlige fødselsdefekter eller aborter baseret på bimatoprost postmarketing erfaring.
I embryoføtale udviklingsundersøgelser resulterede administration af bimatoprost til gravide mus og rotter under organogenese i abort og tidlig levering ved orale doser mindst 33 gange (mus) eller 94 gange (rotter) den humane eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt ( baseret på blodareal under kurven [AUC] niveauer). Disse bivirkninger blev ikke observeret ved 2,6 gange (mus) og 47 gange (rotter) den humane eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt (baseret på blodets AUC-niveauer).
præ/postnatale udviklingsundersøgelser resulterede administration af bimatoprost til drægtige rotter fra organogenese til slutningen af diegivningen i reduceret drægtighedslængde og føtal kropsvægt og øget føtal og hvalpedødelighed ved orale doser mindst 41 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt (baseret på blodets AUC-niveauer). Der blev ikke observeret nogen bivirkninger hos rotteafkom ved eksponeringer estimeret til 14 gange den humane eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt (baseret på blodets AUC-niveauer).
Da reproduktionsstudier hos dyr ikke altid forudsiger human respons, bør LUMIGAN® 0,01% kun administreres under graviditet, hvis den potentielle fordel opvejer den potentielle risiko for fosteret.
Data
Dyredata
et undersøgelse af embryoføtal udvikling hos rotter blev abort observeret hos gravide rotter, der fik bimatoprost oralt under organogenese ved 0,6 mg/kg/dag (94 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt, baseret på AUC). No Observed Adverse Effect Level (NOAEL) for abort var 0,3 mg/kg/dag (estimeret til 47 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt, baseret på AUC). Der blev ikke observeret nogen abnormiteter hos rottefostre ved doser op til 0,6 mg/kg/dag.
et undersøgelse af embryoføtal udvikling af mus blev abort og tidlig levering observeret hos gravide mus, der fik bimatoprost oralt under organogenese i doser større end eller lig med 0,3 mg/kg/dag (33 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt, baseret på AUC). NOAEL for abort og tidlig fødsel var 0,1 mg/kg/dag (2,6 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt, baseret på AUC). Der blev ikke observeret abnormiteter hos musefostre ved doser op til 0,6 mg/kg/dag (72 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt, baseret på AUC).
et præ/postnatalt udviklingsstudie resulterede behandling af drægtige rotter med bimatoprost oralt fra drægtighedsdag 7 til diegivningsdag 20 i reduceret drægtighedslængde, øgede sene resorptioner, føtal dødsfald og postnatal ungerdødelighed og reduceret ungernes kropsvægt ved doser større end eller lig med 0,3 mg/kg/dag. Disse virkninger blev observeret ved eksponeringer på mindst 41 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt baseret på AUC. NOAEL for postnatal udvikling og parringsydelse af afkommet var 0,1 mg/kg/dag (estimeret til 14 gange den humane systemiske eksponering for bimatoprost 0,03 % doseret bilateralt én gang dagligt, baseret på AUC).
Amning
Risikooversigt
Det vides ikke, om topisk okulær behandling med LUMIGAN® 0,01% kan resultere i tilstrækkelig systemisk absorption til at producere påviselige mængder i modermælk. I dyreforsøg har bimatoprost vist sig at være til stede i modermælk fra diegivende rotter i en intravenøs dosis (dvs. 1 mg/kg) 970 gange RHOD (på mg/rn 2-basis), dog er der ingen dyredata tilgængelige ved klinisk relevante doser.
De udviklingsmæssige og sundhedsmæssige fordele ved amning bør overvejes sammen med moderens kliniske behov for LUMIGAN® 0,01 % og eventuelle potentielle bivirkninger på det ammede barn fra LUMIGAN® 0,01 %.
Pædiatrisk brug
Brug til pædiatriske patienter under 16 år anbefales ikke på grund af potentielle sikkerhedsproblemer relateret til øget pigmentering efter langvarig kronisk brug.
Geriatrisk brug
Der er ikke observeret nogen overordnede kliniske forskelle i sikkerhed eller effektivitet mellem ældre og andre voksne patienter.
OVERDOSIS
Der er ingen tilgængelig information om overdosering hos mennesker. Hvis der opstår overdosering med LUMIGAN® (bimatoprost oftalmisk opløsning) 0,01 %, bør behandlingen være symptomatisk.
I orale (ved sonde) undersøgelser af mus og rotter gav doser op til 100 mg/kg/dag ingen toksicitet. Denne dosis udtrykt som mg/m2 er mindst 210 gange højere end den utilsigtede dosis af en flaske LUMIGAN® 0,01 % til et barn på 10 kg.
KONTRAINDIKATIONER
LUMIGAN® 0,01% er kontraindiceret til patienter med overfølsomhed over for bimatoprost eller over for et eller flere af indholdsstofferne [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Handlingsmekanisme
Bimatoprost, en prostaglandinanalog, er en syntetisk strukturel analog af prostaglandin med okulær hypotensiv aktivitet. Det efterligner selektivt virkningerne af naturligt forekommende stoffer, prostamider. Bimatoprost menes at sænke det intraokulære tryk (IOP) hos mennesker ved at øge udstrømningen af kammervand gennem både det trabekulære netværk og uveosklerale veje. Forhøjet IOP udgør en væsentlig risikofaktor for glaukom-felttab. Jo højere niveau af IOP, jo større er sandsynligheden for skade på synsnerven og tab af synsfelt.
Farmakokinetik
Absorption
Efter en dråbe bimatoprost oftalmisk opløsning 0,03 % blev administreret én gang dagligt i begge øjne hos 15 raske forsøgspersoner i to uger, toppede blodkoncentrationerne inden for 10 minutter efter dosering og var under den nedre detektionsgrænse (0,025 ng/ml) hos de fleste forsøgspersoner inden for 1,5 time efter dosering. Gennemsnitlige Cmax og AUC0-24 timers værdier var ens på dag 7 og 14 ved henholdsvis ca. 0,08 ng/ml og 0,09 ng•time/ml, hvilket indikerer, at steady state blev nået i løbet af den første uge af okulær dosering. Der var ingen signifikant systemisk lægemiddelakkumulering over tid.
Fordeling
Bimatoprost er moderat fordelt i kropsvæv med et steady-state distributionsvolumen på 0,67 l/kg. I humant blod findes bimatoprost hovedsageligt i plasmaet. Ca. 12 % af bimatoprost forbliver ubundet i humant plasma.
Elimination
Metabolisme
Bimatoprost er den vigtigste cirkulerende art i blodet, når den når det systemiske kredsløb efter okulær dosering. Bimatoprost gennemgår derefter oxidation, N-deethylering og glucuronidering for at danne en mangfoldighed af metabolitter.
Udskillelse
Efter en intravenøs dosis af radioaktivt mærket bimatoprost (3,12 mcg/kg) til seks raske forsøgspersoner var den maksimale blodkoncentration af uændret lægemiddel 12,2 ng/ml og faldt hurtigt med en eliminationshalveringstid på ca. 45 minutter. Den totale blodclearance af bimatoprost var 1,5 l/time/kg. Op til 67 % af den administrerede dosis blev udskilt i urinen, mens 25 % af dosis blev genfundet i fæces.
Kliniske Studier
I et 12-måneders klinisk studie med patienter med åbenvinklet glaukom eller okulær hypertension med en gennemsnitlig baseline IOP på 23,5 mmHg, var den IOP-sænkende effekt af LUMIGAN® 0,01 % én gang dagligt (om aftenen) op til 7,5 mmHg.
PATIENTOPLYSNINGER
Potentiale for pigmentering
Rådgiv patienterne om potentialet for øget brun pigmentering af iris, som kan være permanent. Informer også patienterne om muligheden for mørkere øjenlågshud, som kan være reversibel efter seponering af LUMIGAN® (bimatoprost oftalmisk opløsning) 0,01 %.
Potentiale for øjenvippeforandringer
Informer patienterne om muligheden for øjenvipper og vellushårforandringer i det behandlede øje under behandling med LUMIGAN® 0,01%. Disse ændringer kan resultere i en forskel mellem øjnene i længde, tykkelse, pigmentering, antal øjenvipper eller vellushår og/eller øjenvippernes vækstretning. Øjenvippeforandringer er normalt reversible ved seponering af behandlingen.
Håndtering af containeren
Instruer patienterne i at undgå at lade spidsen af dispenseringsbeholderen komme i kontakt med øjet, omgivende strukturer, fingre eller enhver anden overflade for at undgå kontaminering af opløsningen med almindelige bakterier, der vides at forårsage øjeninfektioner. Alvorlig skade på øjet og efterfølgende tab af synet kan skyldes brug af kontaminerede opløsninger.
Hvornår skal man søge lægeråd
Rådgiv patienter om, at hvis de udvikler en interkurrent øjenlidelse (f.eks. traumer eller infektion), får øjenkirurgi eller udvikler øjenreaktioner, især konjunktivitis og øjenlågsreaktioner, skal de straks søge deres læges råd angående fortsat brug af LUMIGAN® 0,01 % .
Brug af kontaktlinser
Informer patienterne om, at LUMIGAN® 0,01 % indeholder benzalkoniumchlorid, som kan absorberes af bløde kontaktlinser. Kontaktlinser skal fjernes før instillation af LUMIGAN® 0,01% og kan genindsættes 15 minutter efter indgivelsen.
Brug sammen med andre oftalmologiske lægemidler
Advisér patienterne om, at hvis der anvendes mere end ét topisk oftalmisk lægemiddel, skal lægemidlerne administreres mindst fem (5) minutter mellem påføringerne.
